- 科技報導
- 生醫先鋒
文章專區
2023-12-15比快篩更準、比qPCR更快?應用CRISPR技術檢測傳染病
504 期
Author 作者
陳淵銓/仁德醫護管理專科學校助理教授
傳染病是造成全球疾病和死亡的主要原因之一,而要預防傳染病傳播、提供有效治療,則需要準確、靈敏、方便、廉價和便攜的快速現場診斷。定點照護檢驗(point-care-testing, POCT)〔註〕是指鄰近受測對象所執行的相關測試或檢驗活動,提供即時、準確的診斷結果,對於預防傳染病傳播及提供正確治療方法來說非常關鍵。現階段常見的傳染病檢驗包括抗原-抗體血清反應(antigen–antibody serum reaction),但此方法有時會不夠靈敏、準確;其次則為聚合酶鏈反應(polymerase chain reaction assay, PCR),可惜不夠快速與方便。幸運地,叢集規則間隔短回文重複序列(clustered regularly interspaced short palindromic repeat, CRISPR)技術有潛力提供一種快速、方便、特異和靈敏地檢測傳染病的POCT。
〔註〕隨著檢測技術的蓬勃發展與應用功能的創新,現今醫療單位所提供的檢驗方式已不再侷限於實驗室內。因應醫療環境的變化及疾病預防、治療的需要,快速且在現場進行的POCT檢驗模式也應運而生。根據國際規範ISO 22870的規定,POCT的定義為:「在病患附近或所在處執行的檢驗,結果可能對病患的照護方式產生改變」
因此POCT應用於醫療檢驗又稱「鄰近病人的檢驗」(near-patient testing)或「床邊檢驗」(bedside testing)。在疾病的預防和治療上,臨床醫師快速診斷疾病需即時獲得檢驗數據,若循常規模式將檢體傳送到實驗室進行檢驗在時效上可能來不及。而藉由POCT所獲得的即時結果,醫師就可快速提供病患相對應及正確的診斷及治療。因此,POCT應兼具快速、特異、靈敏、便利,以及無須特殊儀器、也無須由專業人員操作等特性。

(Adobe Stock)
傳染病檢測的傳統方法
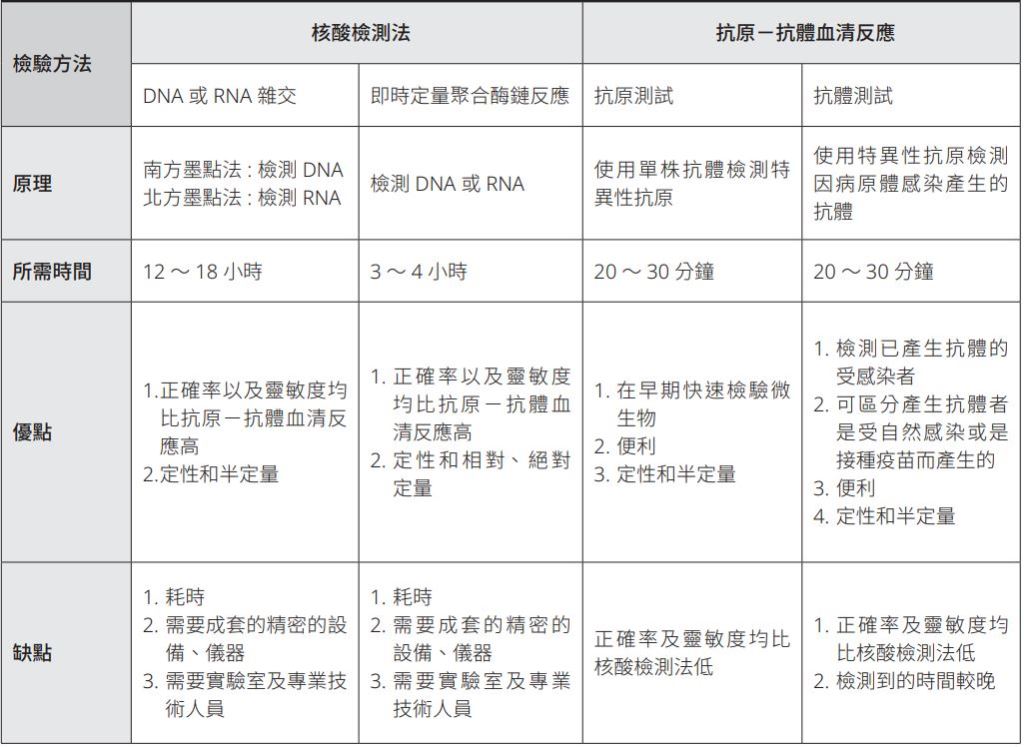
為了避免病原體傳播及快速治療傳染病,使用適當的診斷方法以準確、靈敏及快速的檢驗病原微生物至關重要。病原檢測方法重類繁多,各種實驗室技術包括核酸檢測法(nucleic acid testing),例如南方墨點法(southern blotting)、北方墨點法(northern blotting)、即時定量聚合酶鏈反應(real-time quantitative polymerase chain reaction, qPCR)等;以及抗原-抗體血清反應,例如補體結合試驗(complement fixation test)、免疫螢光試驗(immunofluorescent assay)及免疫吸附試驗(immunosorbent assay)等,皆可用於診斷傳染病和病原體(表一)。然而,核酸檢測耗時,需要超過四小時甚至24小時,而且還需要大量工作、設備、儀器和專業人員;而抗原-抗體血清反應的靈敏度和準確性,常有所不足。
 .
.
表一|傳統檢驗傳染病及病原體方法的比較
CRISPR技術應用於定點照護檢驗
目前市面上對於同時兼顧靈敏度和準確性,又有便攜、快速這兩者優點的POCT需求量仍相當大。幸運的是,CRISPR技術有潛力用於傳染病檢測,包括多種病原體,顯示它可作為一個快速、便攜、簡單及一次性的POCT平臺。目前已經有多種病原體正在研發階段,舉例說明如下:
1.新型冠狀病毒(SARS-CoV-2)
2020年,中國深圳的研究團隊發表了一種以CRISPRCas12a系統偵測新型冠狀病毒開放閱讀框(open reading frame, ORF)的ORF 1ab和核殼蛋白(nucleocapsid (N) protein)基因的檢測方法。他們結合CRISPR技術與重組酶聚合酶擴增(recombinase polymerase amplification, RPA)快速處理樣品,結果可用肉眼觀察或使用螢光讀數器(fluorescence readout)進行評估。研究人員使用反轉錄定量聚合酶鏈反應(reverse transcriptasequantitative polymerase chain reaction, RT-qPCR)檢測22個臨床檢體,將此結果與CRISPR-Cas12a系統的檢測結果做比較,發現陰性和陽性樣品的檢測結果與RT-qPCR讀數之間均具有100%的一致性,而且可以在50分鐘內獲得結果,且靈敏度高。因此,CRISPRCas12a的診斷方法有機會用於POCT,有助於有效控制COVID-19大流行、提供即時有效治療。
2.人類乳突病毒(human papillomavirus, HPV)
去(2022)年來自中國河南鄭州的研究團隊發表以CRISPR-Cas12a/Cas13a雙重系統結合多重重組酶輔助擴增(recombinase-aided amplification, RAA)快速檢測HPV16/18的方法,可用於篩檢子宮頸癌。研究團隊設計了一種便攜式螢光成像測定法,可以直接透過肉眼觀察或手機成像來區分測試結果。研究結果顯示,HPV16和HPV18的檢測極限(limit of detection, LOD)均為1 copy/μL(每微升的複製數),再使用55個臨床檢體驗證該雙重系統後,顯示出97.06%的靈敏度、100%的特異性、100%的陽性預測值和96.55%的陰性預測值。因此,CRISPR-Cas(Cas12和Cas13)系統的檢測有可能成為HPV檢測的POCT,具有快速、便攜、特異、靈敏和準確的特點。
3.B型肝炎病毒(hepatitis B virus, HBV)
在2021年同樣由中國河南鄭州的研究團隊發表了以環介導擴增(loop-mediated amplification, LAMP)-Cas12a進行HBV的檢測方法。此處採用側流試紙(lateral flow test strip)技術,測試結果肉眼可見的結果;還能以讀取螢光的方式,完成即時高靈敏度檢測。螢光讀數器的Cas12a檢測可在13分鐘內檢測出LOD為1 copy/μL的HBV,而側流試紙條法也僅需20分鐘。研究團隊使用73個臨床檢體進行驗證評估,發現LAMP-Cas12a的檢測(包括螢光讀數和側流試紙條法)的靈敏度和特異性均達到100%。結果顯示使用LAMP-Cas12a的HBV檢測只需最少的設備即可獲得快速、準確的結果,完全可與qPCR相媲美,而且該方法經過不斷改善後,展示出特異性佳及抗干擾性強的特點。

(Adobe Stock)
4.C型肝炎病毒(hepatitis C virus, HCV)
去年泰國清邁的研究團隊發表並驗證了一種快速、準確的HCV RNA檢測方法,該方法結合RT-LAMP和CRISPR-Cas12a檢測,用於識別HCV特定的RNA序列。研究團隊分別以感染了HCV、HIV或HBV的患者、以及健康人的臨床檢體進行測試。在靈敏度測試的部分,100個已知有感染HCV的血漿檢體中,藉由側流試紙條和螢光讀數器等兩種讀數檢測後,有93個檢體呈陽性;第二次重新檢測後,只有四個檢體保持陰性,也就是說第一輪和第二輪的靈敏度分別為93%和96%。在特異性測試的部分,使用了30個樣本,當中包括HBV感染者HIV感染者、健康者各10位;與對照方法qRT-PCR相比,RT-LAMP結合CRISPR/Cas12檢測的靈敏度和特異性分別為96%和100%,一致性為97%,而檢測到的HCV RNA的LOD為10 ng/μL(奈克/微升),估計為2.38 Log IU/mL〔註〕。因此,RT-LAMP和CRISPRCas12a檢測有機會成為一種經濟實惠且可靠的HCV POCT,在缺乏資源的環境中具有應用潛力。
〔註〕國際單位(international unit, IU)是用生物活性或生物效價來表示某些維生素、激素、藥物(例如抗生素、疫苗、血液製劑)及類似的生物活性物質的藥理計量單位。
CRISPR技術進行檢測的前景與限制
CRISPR技術提供一種便攜式診斷方法,結合qPCR和抗原-抗體血清反應快速、準確、特異性和方便等優點,且有些已針對標靶(target)進行嚴格驗證,在檢測各種微生物包括細菌、真菌、病毒和寄生蟲方面顯示出潛力。部分技術不僅處於基礎研究或臨床試驗階段,甚至已進入臨床應用、逐漸商業化,顯示出可作為臨床POCT的前景。例如美國Mammoth Biosciences公司開發的CRISPR-Cas12檢測方法已於去年1月獲得美國食品和藥物管理局的緊急使用授權(emergency use authority, EUA),用於新型冠狀病毒的臨床檢測。然而,將CRISPR技術應用到POCT仍存在一些限制。
首先,CRISPR技術的測定雖與抗原-抗體血清反應一樣可用肉眼區辨,但這只是估計結果,而不是精確結果。另一方面,相較於qPCR反應,CRISPR技術檢測的特異性和準確性雖然相近,但結果只是半定量的,不能如qPCR反應提供檢測的循環數閾值(threshold of cycle, Ct)作為定量參考。此外,CRISPR技術的檢測極限較高,因此靈敏度低於qPCR反應,且檢測所獲數據並不是線性的,如果想獲得更精確的結果,仍需要進行qPCR來作雙重驗證和確認結果。因此,有必要再降低檢測極限,並持續探索使用CRISPR技術檢測的數據線性關係。
其次,並非所有病毒體的檢測標靶基因,也就是特定的DNA/RNA序列都可以輕易被篩選。為了保持檢測穩定性,需要選擇不易突變的標靶基因,例如CRISPR技術的檢測中,通常選擇新型冠狀病毒的N基因和/或E基因作為COVID-19檢測標靶,因為它們比S基因更穩定。但選擇合適的標靶基因相當麻煩且困難,有時甚至幾乎不可能。此外,用於檢測的標靶基因只是相對穩定,並非真的永久不變;因此為了確保CRISPR技術的檢測準確度、精密度和穩定性,可能需要定期檢測,以了解標靶基因的穩定性。
最後,精確設計高度特異性和高效的CRISPR RNA (crRNA)和等溫引子(isothermal primer),對於CRISPR技術的臨床應用至關重要,設計過程需要密集的管理和嚴格的參數,以最大限度地減少脫靶檢測。因此,有必要開發單一且簡化的生物資訊平臺,協助快速設計用於CRISPR平臺的crRNA。幸運的,目前已出現PrimedSherlock平臺,已經開發出來一種自動化的計算機引導流程,用於選擇針對標的基因具有高度特異性的crRNA和引子,可以顯著提高CRISPR技術的檢測效率。
具POCT潛力的CRISPR技術
傳染病和病原體的早期檢測對於有效的疾病治療、控制和預防至關重要。目前,核酸檢測和抗原-抗體血清反應是檢測傳染病最常用的兩種方法。前者準確度高、特異性強、靈敏度高,但耗時長、成本高,並對技術人員和設備、儀器有特殊要求;後者快速且方便,但準確性和靈敏度可能不夠。因此,開發快速、現場的即時診斷測試是必要的,以實現準確、靈敏、方便、廉價、便攜性的傳染病臨床檢測。CRISPR技術檢測的強大能力將促進POCT診斷工具的進一步發展,儘管目前此法仍然存在一些限制,但長期而言仍有潛力作為當前傳統檢測的替代方法或另一種選擇。
延伸閱讀
1. Xiong, D. et al. (2020). Rapid detection of SARS-CoV-2 with CRISPRCas12a. PLoS biology, 18(12), e3000978.
2. Zheng, X. et al. (2022). Rapid detection of HPV16/18 based on a CRISPR-Cas13a/Cas12a dual-channel system. Analytical Methods, 14(48), 5065-5075.
3. Ding, R. et al. (2021). CRISPR/Cas12-based ultra-sensitive and specific point-of-care detection of HBV. nternational journal of molecular sciences, 22(9), 4842.