Author 作者
蔣維倫/泛科學PanSci專欄作家、故事專欄作家、udn鳴人堂專欄作家、前國衛院衛生福利政策研究學者。喜歡虎斑、橘子、白底虎斑和三花貓。
2021.06.17作者補充:德國的mRNA疫苗藥廠——CureVac,於6月16日公布COVID-19疫苗的三期試驗數據,保護力僅47%,未達預設的50%最低標準。 但該疫苗(CVnCoV 12 µg)在一期試驗的抗體中和病毒效價,數值和康復者血清相差無幾,皆為113;若以《自然醫學》的研究而言,CureVac的疫苗保護力應介於AZ疫苗和俄國的史普尼克疫苗之間。換言之,CureVac藥廠的實驗結果,說明「抗體中和效價=真實保護力」論點,仍有待更多的思考。
隨著第一批完成試驗的COVID-19疫苗推出與大規模施打,研發進度稍慢的幾組疫苗,卻面臨到難以進行第三期臨床試驗的困境。那麼,在缺乏三期數據的情況下,科學上還有哪些方法能驗證疫苗的保護力嗎?

即便已經有數支COVID-19疫苗開始大量施打,然而這場疫苗研發之戰還未結束,落後的疫苗將何去何從?(CC0)
三期臨床試驗,對疫苗開發而言,是證明疫苗保護力的重要根據。這個階段多為隨機雙盲安慰劑設計(randomised placebo-controlled trials),受試者將分為兩群,一群注射疫苗、另一群注射毫無保護力的物質。受試者所屬的環境中原本即有疫情,因此為潛在有病毒的環境,試驗的重點即在於觀察施打疫苗與否,是否能減少病毒的感染。
目前已執行且取得三期數據的有牛津(AstraZeneca, AZ)、輝瑞-BNT(pfizer-BioNTec)、莫德納(Moderna)、嬌生、科興、諾瓦瓦克斯(Novavax)、國藥等。
今(2021)年5月26日召開會議,世界衛生組織(World Health Organization, WHO)邀請在疫苗賽道上具備潛力,但尚未進行三期臨床試驗的藥廠們討論「以免疫數值,取代三期臨床試驗」的可行性。
啊,那可以不做三期試驗了嗎?WHY?
為什麼接下來要做三期試驗很難?
COVID-19爆發一年多,疫苗跑道上分成兩群,領先群是已取得三期臨床數據的疫苗,緊接在後的是手握二期試驗成果,但尚未展開三期的疫苗,代表是越南的 Nano Covax、臺灣的高端疫苗等。
然而,在各國紛紛取得領先群的疫苗為民眾接種的現況下,那些尚未進行三期臨床的疫苗有可能面臨「沒地方做三期試驗」的困境。
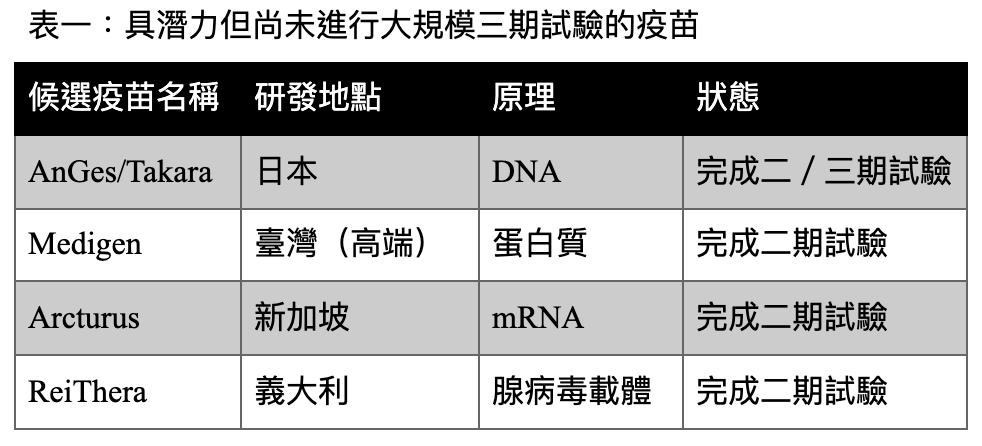
註:本表為簡列,類似狀態的疫苗在全球約有十數支。資料來源: Dal-Ré et al., 2021; Zmmier et al., The New York Times, 2021.
道德面來說,若科學家已擁有已知效力的疫苗,仍讓受試者注射無效果的安慰劑,並持續生活在有風險的疫區,是不仁慈且不道德的 。
在人體試驗中,研究人員必須秉持對受試者的最大利益著想。因此,規畫COVID-19疫苗的三期臨床試驗,若仍讓受試者接受毫無效果的安慰劑,恐招來非議,同時也一定會在輿論或政壇裡引起紛爭。
現實面來說,站在執政者的角度思考。若國內每日新增病例上千、甚至破萬的巨大壓力下,政府肯定迫切期待疫苗援助,而不願允許未知療效的疫苗,對本國人民進行試驗。在此現實考量下,藥廠要尋得「願意接受他國疫苗對本國人民做人體試驗」的國家,將愈發困難。
上述困境,不僅限制了研發較慢的疫苗在他國進行三期臨床的可行性,甚至於在母國亦有所困難。假設藥廠計畫在母國進行三期試驗,若國內無本土疫情,則不可能進行;若國內有本土疫情,輿論壓力也會壓縮可行性空間,產生「怎麼可以用本國人民當小白鼠?」及「我們需要疫苗,越快越好!」的矛盾壓力。
新疫苗還是要研發,效用該怎麼證明?
然而,許多仍在研發的疫苗在實務抗疫策略上,有其重要性。因為這些步伐較慢的疫苗,在技術層面上,有可能更適合中、小型國家生產(不是每個國家都能研發mRNA疫苗這種高超技術的疫苗),成本更低廉(國家的預算都有上限)、更適合運輸等。
由於COVID-19已經完全地深入人類社會,在可見的未來裡,社區爆發群聚感染將成常態。因此「每個人都要接種COVID-19疫苗」不應是期許,而是一種要求。那麼,如何讓這些難以進行三期試驗的疫苗能完成驗證?科學上,有沒有可能「不做隨機雙盲安慰劑的三期試驗」,也能證明疫苗足夠有效呢?
疫苗效用隨機分組試驗
首先,一個做法是考慮採用疫苗效用隨機分組試驗,也就是將「試驗國已授權」和「候選疫苗」的pk。
以臺灣為例,可將受試者隨機分為「AZ疫苗」和「候選疫苗」兩組,以雙盲的方式給予疫苗,在足夠長的時間下、整體感染者累積至目標值後,再解盲確認AZ疫苗和候選疫苗的保護力比較,進而推斷候選疫苗的能力。
為了確保受試者的最大利益,在試驗中期、初步證明候選疫苗效力後,就應讓全體受試者都接受有效的疫苗(若候選疫苗無效,則須讓「候選疫苗組」受試者追加接種「試驗國已授權」的疫苗;若有效,則無須追加),以降低受試者因臨床試驗遭受損害的程度。
此設計的優點,是在保護受試者權益和評估疫苗效力之間,取得妥適的平衡;不會有人因安慰劑而受害。然而,該設計的缺點是需龐大的受試者人數,可能數千或萬人,而需數月到數年的試驗時間成本也是令人卻步的門檻。
免疫橋接研究
另外一個做法,是針對疫苗引起的免疫反應進行驗證,也就是免疫橋接研究(immuno bridging study)。
要以免疫橋接研究的結果來判斷疫苗的效用,科學家必須先取得共識,確認某種免疫反應,可有效保護人類抵禦COVID-19感染;再透過研究「普遍已認證」的疫苗們,所產生的免疫反應,建立、換算出標準值。
若「候選疫苗」的免疫反應不弱於(non-inferiority immunogenicity trials)被認定的標準值,則可推斷該候選疫苗擁有合格的保護力。
此設計的優點,是不用進行耗時的三期試驗,僅需研究、定量二期試驗受試者體內的免疫反應。不僅節省了大量的時間、金錢的花費,同時也為後續的COVID-19疫苗建立了可信賴的標準。
然而,該設計的缺點是科學家必須取得共識,何種免疫反應能代表COVID-19的免疫力?
免疫橋接研究初步探索成果
首先要解決的問題是,能否以初始抗體強度,預測疫苗保護力?
《自然醫學》(Nature Medicine)在5月下旬發表了一篇論文,研究團隊研究7種COVID-19疫苗的接種者及康復者體內的抗體,了解其對病毒的中和能力,試圖找出足以代表疫苗保護力的免疫反應。
研究團隊參考、模仿人類較熟知的疾病——流行性感冒,透過過往已建立的數學模型,加上目前資料較充分的COVID-19疫苗臨床數據,得出一個相關預測模型,繪製出圖一。該圖之Y軸為疫苗的真實世界保護率,而X軸是疫苗在接種者體內產生的抗體強度〔註一〕。
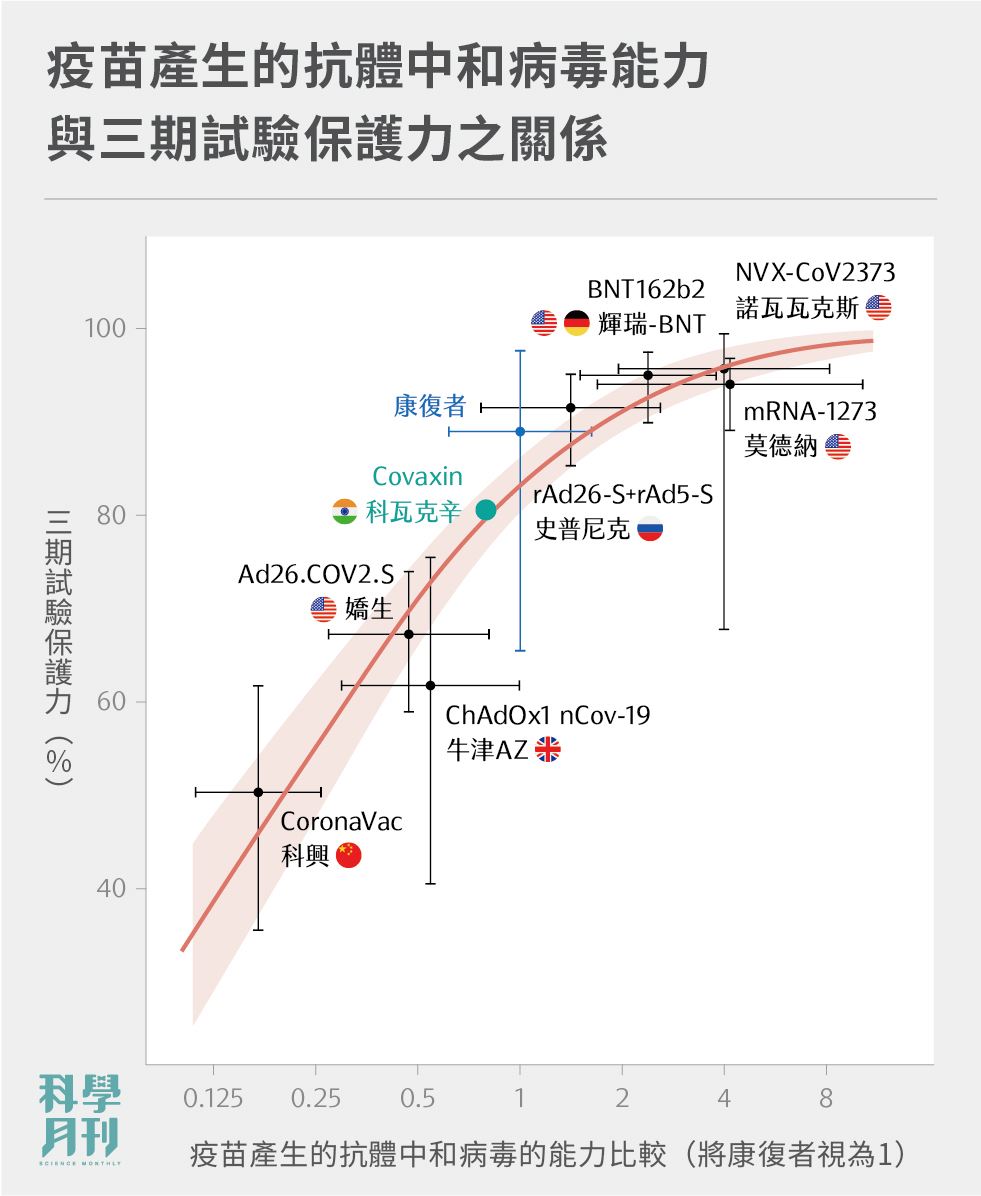
圖一:疫苗在一或二期臨床試驗中,產生之抗體對於中和原始株病毒的強度(設康復者血清抗體強度為1),和其疫苗在三期試驗中表現之保護力的比較。資料來源: Khoury et al., 2021.
圖上,紅色實線是團隊模擬後的模型,橘紅底範圍是該模型的95%信心區間範圍。該模型預測的能力似乎相當不錯;換言之,由一、二期試驗的血清抗體強度數據,該模型就能預測疫苗在三期試驗的整體保護力。
舉例來說,以該模型計算,若候選疫苗接種者抗體強度達康復者的20.2%水準,那麼就可預測該疫苗在真實世界的保護力可達50%。
而團隊利用該模型推算另一支印度的去活性病毒疫苗Covaxin,該疫苗的抗體強度為康復者的79.2%,模型推測真實保護力為79.6%(95%信心區間為76.2~83.0%),而新聞稿的三期試驗保護力是80.6%。高度吻合的數據顯示該模型有良好的預測價值。
換言之,僅完成二期試驗的疫苗,未來有機會應用該數學模型,預測自家疫苗的真實世界保護力。
其次,打了疫苗,可以有多久的保護力呢?要回答這個問題,科學家也嘗試以初始抗體強度,預測保護力衰退速度。前述的團隊也透過康復者抗體的衰退資料(康復者痊癒後250天的數據顯示,抗體中和病毒強度衰退的半衰期約108天),推測出疫苗初始保護力和衰退的速度。
如圖二,若疫苗的初始保護力約50%(如:中國科興疫苗),大約半年後,保護力將僅剩兩成。若接種AZ疫苗(初始保護力約70%),則半年後的保護力降至約四成多。若接種初始保護力約95%的疫苗(如:莫德納),則半年後保護力可能仍超過八成〔註二〕。
此衰退的模型,也將有助於推估「何時要補打?」,藉此和民眾宣導COVID-19疫苗的接種頻率,以決定採購、衛教宣導等政策。
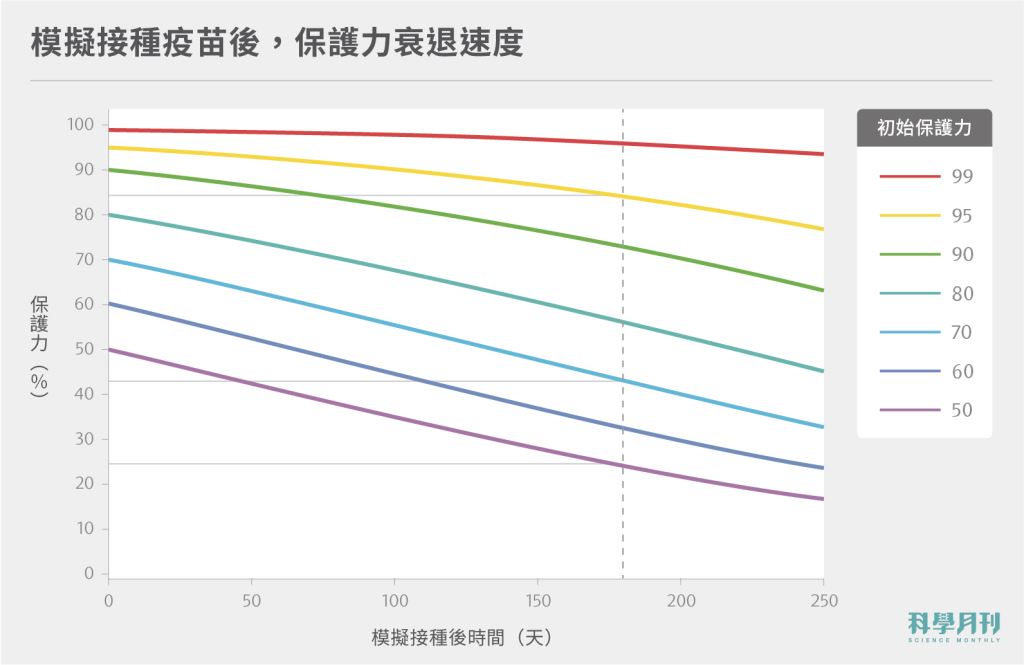
圖二:以康復者血清抗體衰退速度(前250天之數據發現,中和病毒的效價半衰期約108天),推算疫苗接種後保護力衰退速度,可用於推測補打頻率。資料來源:From: Khoury et al., 2021.
最後,面對病毒新變異株的威脅,是否能透過數據了解到疫苗的保護力呢?研究團隊也嘗試透過抗體中和數據,來預測對病毒新變異株的保護力。
依該模型計算,若實驗室發現某疫苗接種者的抗體,中和新變異株的效力降低5倍,那麼可利用模型換算出對應結果:若疫苗原始保護力為95%,則對抗變異株的保護力將稍降至77%;若原始保護力為70%,則對變異株保護力將驟降至32%;若原始保護力為50%,則對變異株的保護力將剩不到10%。
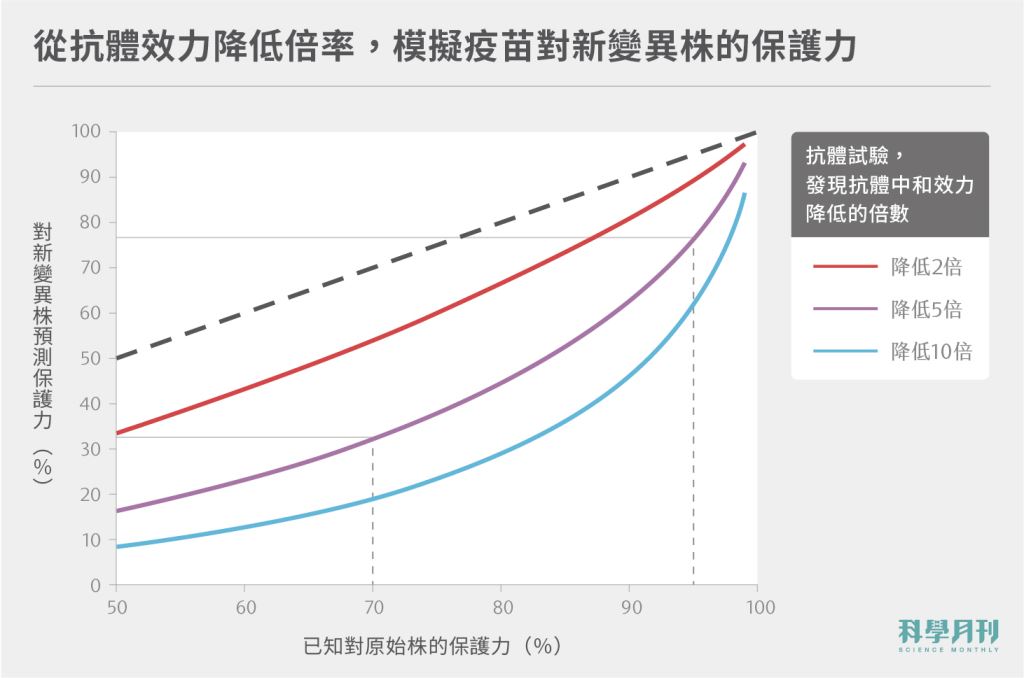
圖三:以模型推算,若疫苗產生之抗體中和新變異株病毒的效力降至2、或5、或10倍時,疫苗原始的保護力與新變異株的保護力對比。資料來源:Khoury et al., 2021.
可以只看抗體預測疫苗保護力嗎?
關於這一點,科學界尚在討論中。
儘管《自然醫學》上的模型相當吸引人,並且推算印度Covaxin疫苗的結果也相當精準,但科學家目前對於免疫橋接研究仍未達成共識。
最大的障礙和擔憂,是「什麼免疫反應才足以代表疫苗保護力?」抗體是夠好的標誌嗎?
在回答這個問題前,讓我們看看另一個呼吸道融合病毒(Respiratory syncytial virus, RSV)疫苗的困境。
RSV是流行於全球的呼吸道病毒。在美國,每年至少十萬人因RSV病毒而住院,它主要感染嬰兒和老年人;重症的年長者甚至有5%的死亡機率。該病毒已經被發現了超過半世紀,儘管它的危害龐大,但科學家始終無法研發出成功的疫苗。甚至曾發生在三期試驗中,疫苗接種者產生致命副作用,導致重症、死亡的慘痛經驗。
最關鍵的原因之一,就是科學界尚無法完全掌握「什麼免疫反應才足以代表疫苗保護力?」這個問題。在RSV的案例中,儘管研究發現,呼吸道黏膜上的IgA抗體能抵禦RSV,但這仍無法保證接種實驗疫苗的受試者,就不會被RSV感染 。換言之,在不清楚何種免疫反應,才能代表疫苗保護力的情況下,藥廠被迫只能使用試誤法,甚至只能招募受試者做攻毒試驗(可控的情況下,自願感染病毒)。
而《自然醫學》研究中,團隊之所以選流行性感冒為模型建構的參考,是因為人類對該疾病擁有足夠的認知。多年的流感大流行累積了豐富的數據,並且也有攻毒試驗留下豐富的資料。透過前人對流感的研究,科學界對於「什麼免疫反應才足以代表流感疫苗的保護力」,已有了較一致的定論〔註三〕。
但COVID-19才出現一年多,人類對它仍非常陌生。在缺乏充足的研究之下,對於「血清抗體中和病毒的強度 = 疫苗保護力」這件事,沒有十足的把握。而美國食品藥物管理局(Food and Drug Administration, FDA)亦在五月發布通知,告知民眾,政府目前不建議用抗體篩檢結果,做為個人免疫力的判斷,也表示了現在科學界對於「抗體 = 保護力」此事,仍有疑慮和討論的空間。
德國的mRNA疫苗藥廠——CureVac,於6月16日公布COVID-19疫苗的三期試驗數據,保護力僅47%,未達預設的50%最低標準。 但該疫苗(CVnCoV 12 µg)在一期試驗的抗體中和病毒效價,數值和康復者血清相差無幾,皆為113;若以《自然醫學》的研究而言,CureVac的疫苗保護力應介於AZ疫苗和俄國的史普尼克疫苗之間。換言之,CureVac藥廠的實驗結果,說明「抗體中和效價=真實保護力」論點,仍有待更多的思考。
三期臨床試驗,和一、二期有個最大的不同,在於會讓接種者實際遇到病毒。
在疫苗史上,曾有少見但令人怵目驚心的致命副作用,如:「抗體依賴性免疫加強反應」(antibody-dependent enhancement, ADE)。指人體雖然對該病毒產生抗體,但抗體無法有效中和後續入侵的病毒,反而使病毒感染細胞的效率增加、引發重症,最著名的例子是登革熱。登革熱有四種血清型,感染某種血清型的登革熱且痊癒後,體內抗體非但不能抵禦其他血清型病毒,反而更容易引起重症。
而呼吸道疾病的疫苗還有另一項需注意之處:若疫苗活化的免疫反應,偏向增加 IL-5 等發炎物質、活化嗜酸性白血球(eosinophil)的TH2反應,則可能在遭遇真正的病毒時,在肺部誘發嚴重的發炎反應,讓大量白血球浸潤在肺臟,引起肺臟損傷。上述兩種疫苗的副作用,都曾引發重症、致死的案例。觀古鑑今,我們應該審慎考量。
COVID-19的免疫橋接研究是科學家必須要透徹搞清楚的課題,因為COVID-19早已深入人類的社會、絕不可能根除。理想的情況下,每個人都應該要接種COVID-19疫苗,以保護脆弱族群(如:年長者、孕婦)。但許多仍在發展中的疫苗,已遭遇三期試驗的實作困境。我們只能期待科學界在效益和風險之間,用證據和研究思辨和討論,早日解開COVID-19更多的謎題吧。
保持冷靜,繼續前進。
Keep Calm and Carry On.
〔註一〕抗體強度:將接種者血清,以不同倍數稀釋後,混入病毒。再將上述混合物和細胞培養,檢視多少的稀釋倍數,還能保護細胞不被病毒感染。最終所獲得的強度數值,來自於將接種者抗體的稀釋倍數和康復者血清抗體稀釋倍數進行比較,康復者的抗體強度被視為參考值1。
〔註二〕不建議民眾用此模型選擇是否要接種疫苗。在疫情嚴峻的現實下,能接種的疫苗就是好疫苗。
〔註三〕目前認為血球凝集抑制實驗(hemagglutination inhibition, HI )可推測疫苗的效力。該實驗是階段性稀釋抗體,觀察哪個稀釋倍數的抗體,仍可中和病毒上的血球凝集蛋白(hemagglutination, HA)、避免病毒和紅血球表面的蛋白質結合。目前認為1:40的稀釋倍數,可推斷此流感疫苗應有50%的保護力。
延伸閱讀
1. Rafael Dal-Ré et al., Ongoing and future COVID-19 vaccine clinical trials: challenges and opportunities, Lancet Infectious Diseases, 2021.
2. David S. Khoury et al., Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection, Nature Medicine, 2021.
3. Robert A. Dudas and Ruth A. Karron, Respiratory Syncytial Virus Vaccines, Clinical Microbiology Reviews, 1998.
4. Stephanie Ascough et al., Local and Systemic Immunity against Respiratory Syncytial Virus Induced by a Novel Intranasal Vaccine. A Randomized, Double-Blind, Placebo-controlled Clinical Trial, American Journal of Respiratory and Critical Care Medicine, 2018
5. Sjanna B. Besteman and Louis J. Bont, Fail-Fast in Respiratory Syncytial Virus Vaccine Development, American Journal of Respiratory and Critical Care Medicine, 2019.
6. A Study to Determine the Safety and Efficacy of SARS-CoV-2 mRNA Vaccine CVnCoV in Adults for COVID-19, ClinicalTrials.gov.