- 科技報導
文章專區
2020-03-13除了COVID-19,也要當心流行性感冒-流感病毒的認識、治療及預防
459 期
Author 作者
陳淵銓/美國加州大學柏克萊分校生物化學博士。
近日,新冠肺炎疫情持續擴大,藥局門口常可看到民眾大排長龍,只為購入口罩與消毒用品。然而,流行性感冒(influenza,以下稱流感)的威力也不容小覷,且病毒每年都在變異,防不勝防。因此,本文將針對流感病毒、病症及治療做介紹,也帶讀者一探近期藥品與疫苗開發上的趨勢。
什麼是流行性感冒?
流感是一種由負鏈單股(negative sense,single-stranded)RNA正黏液病毒科(Orthomyxoviridae)病毒所造成的傳染性疾病。目前,可感染人類的流感病毒分成A、B、C三型,傳染途徑包括飛沫傳播(患者的飛沫傳播到他人的眼、口或鼻)、空氣傳播(健康者吸入患者因咳嗽、噴嚏或痰液而產生的懸浮粒子)及接觸傳染(直接接觸患者分泌物或受病毒污染的物體,再碰觸其它部位)。流感雖與普通感冒(cold)的症狀及傳染途徑類似,但仍有顯著不同處(表一)。
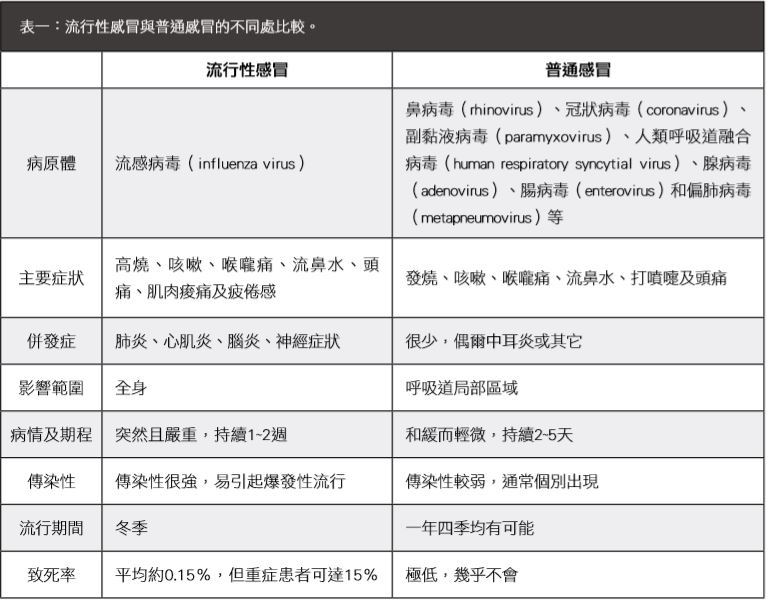 表一:流行性感冒與普通感冒的不同處比較。
表一:流行性感冒與普通感冒的不同處比較。
流感病毒的特性及對應藥物
知道流感與普通感冒的差異後,筆者要帶大家瞭解一下流感病毒的結構。流感病毒一般呈球狀,直徑約在80~120奈米(nm),亦有部分種類呈絲狀(如C型流感病毒),雖形狀不固定,但基本結構類似。如圖一所示,流感病毒最外層結構是外套膜(envelope),內部含有RNA基因組及其它蛋白質,表面則有血球凝集素(hemagglutinin, HA)及神經胺酸酶(neuraminidase, NA)兩種主要醣蛋白(glycoprotein)。
圖一:流感病毒顆粒結構圖。
該病毒感染人類的途徑為何?由於流感病毒的HA會與宿主上皮細胞表面的唾液酸(sialic acid)結合,在HA被蛋白酶切割後,藉由細胞內吞作用(endocytosis)使RNA基因組進入宿主細胞中;而NA則可在病毒顆粒(virion)成熟後,將它表面上的醣類切割下來,以利其自宿主細胞釋出;外套膜上的質子選擇性蛋白質-基質蛋白2(matrix protein 2, M2),則會形成一個離子通道(ion channel),使得病毒RNA得以釋出並進入宿主細胞進行表現。
宿主在被流感病毒感染後,體內對抗HA及NA抗原的抗體力價(titer)會升高。此外,因HA、NA及M2對病毒十分重要,故常成為抗病毒藥物的標靶物質,目前已上市的三種主要抗流感藥物:
1.神經胺酸酶抑制劑(neuraminidase inhibitor, NAI):作用於NA,可阻斷成熟的流感病毒脫離宿主細胞,從而抑制流感病毒在人體內的傳播,對A、B型流感均有效,如克流感(Tamiflu®,Oseltamivir)。
2. M2蛋白質抑制劑(M2 protein inhibitor, M2PI):抑制M2離子通道以阻斷A型流感病毒的複製,在A型流感的感染初期有效,但對於缺乏M2離子通道的B型流感幾乎無效,如金剛烷胺(Amantadine)及金剛乙胺(Rimantadine)。
3.帽依賴性核酸內切酶抑制劑(cap-dependent endonuclease inhibitor, CDEI):流感病毒轉錄mRNA時,需要以核酸內切酶切除宿主細胞RNA前10~20個殘基作為病毒mRNA的5'帽(cap),使得轉錄作用可以啟動。CDEI水解成baloxavir後可抑制病毒聚合酶酸性核酸內切酶(polymerase acidic endonuclease)的活性,使得mRNA無法合成而阻止病毒複製,對A、B型流感均有效,如Xofluza®(Baloxavir marboxil)。
市售的流感預防疫苗
若尚未感染此種病毒,接種疫苗則是預防流感最有效的方法,然而,仍然會遇到一些問題。
首先,流感病毒進行RNA複製所用的RNA依賴性RNA複製酶(RNA dependent RNA polymerase)在校讀(proof reading)上的效率不佳,造成合成的病毒有些許突變,使得病毒表面抗原隨時間呈線性變化,此稱抗原漂變(antigenic drift)。再來,如果同一宿主細胞同時感染兩種以上的流感病毒,基因組可能會發生交換重組(reassortment),引起表面抗原的劇烈變化,稱為抗原移型(antigenic shift)。
這些變化可能會導致宿主的免疫系統無法及時反應,所以當前的流感疫苗通常僅能提供短暫幾年的保護,目前市售疫苗類型包括以下三種:
1. 不活化流感疫苗(inactivated influenza vaccine):由裂解的病毒(split virus)或是次單位(subunit)組成流感抗原。病毒顆粒經化學藥品或清潔劑破壞後生成裂解的病毒;次單位疫苗則包含HA和部分NA蛋白,再經化學藥品或洗滌劑分解後純化製成,生產方式有雞蛋型(eggbased,圖二)與細胞型(cellbased)兩種。
(1)雞蛋型:具高生產力且生產成本低。然而,用禽類組織培養人類病毒的過程中,所產生的卵適應性突變可能會累積並改變病毒的抗原性(antigenicity)。
(2)細胞型:生物反應器中細胞培養的病毒,生產比雞蛋型更方便、快速。此外,因細胞型疫苗的卵適應突變較少,可對年長者(≥65 歲)提供較高的疫苗有效性 (vaccine effectiveness)。

圖二:照片中的實驗工作者正將一種流感病毒注射到雞蛋裡,此為傳統流感疫苗的複雜步驟之一。(U.S. Food and Drug Administration)
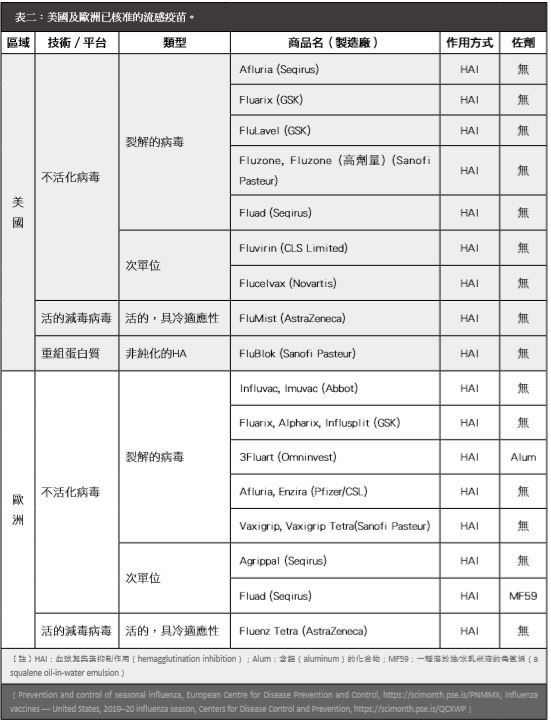 表二:美國及歐洲已核准的流感疫苗。
表二:美國及歐洲已核准的流感疫苗。
2.活的減毒流感疫苗(live,attenuated influenza vaccine):結合HA和NA的活減毒冷適應性(live attenuated cold-adapted)〔註一〕的現行流行病毒株,製成可由鼻腔投予的疫苗。此減毒病毒株在人類上呼吸道僅具有限的複製能力,且整個過程均在感染部位進行,除引起抗體反應外,另可引發細胞介導的免疫作用(cellmediated immunity)和局部粘膜的免疫作用(local mucosal immunity)。此種疫苗在臨床表現的總體療效與不活化流感疫苗相當,但用在成人和兒童的療效則更好。
3. 重組血球凝集素疫苗(recombinant hemagglutinin vaccine):利用桿狀病毒(baculovirus)的表達系統在昆蟲細胞中生產重組HA,然後純化配製成玫瑰花型的HA三聚體。此疫苗不僅具有與細胞型疫苗相同的快速、靈活和可擴展優勢,也避免在疫苗生產時對流感病毒複製的依賴及病毒株選擇過程的耗時費事。舉例來說,適用於50歲以上族群的重組疫苗FluBlok,就被發現比傳統的不活化流感疫苗療效高30%。
新世代流感疫苗的發展趨勢
由於現今季節性流感疫苗缺乏針對抗原漂變、抗原移型或大規模流行性流感病毒株的功效,故開發具有廣泛免疫力的改良型疫苗仍是全球公共衛生的重點。目前疫苗的免疫反應集中在HA頭部區域(head domain)〔註二〕,下一代疫苗的目標應是聚焦在較保守(變異性較小)的病毒結構,如HA莖部(stem domain)。
用來提高疫苗效力的策略包括:使用奈米顆粒以優化標的抗原的抗原性、添加新型佐劑、增加抗原劑量,以及刺激細胞免疫和標靶作用於如NA、M2或核蛋白(nucleoprotein)等病毒蛋白。此外,利用醣工程技術(glycoengineering)去除流感病毒表面抗原上的聚醣屏蔽(glycan shield)可增加疫苗的免疫原性(immunogenicity),讓免疫系統對特定抗原能產生免疫反應。目前,已有多種新型流感候選疫苗正在進行臨床前試驗或臨床人體試驗。
結論
現今有雞蛋型、細胞型及重組蛋白型共三種技術被批准用於生產流感疫苗。大多數許可疫苗都是使用雞蛋胚胎生產,雖然這種生產系統數十年來不變,但仍能滿足當前全球對季節性流感疫苗需求。有鑑於流感仍是目前唯一需要每年接種疫苗的季節性傳染病,下一代流感疫苗應著重在開發「可增強並延長人體免疫力」的新抗原及新型佐劑,建立更快速的細胞培養疫苗生產系統,最終目標是發展出能引發終身免疫力及對抗所有流感病毒的全功能疫苗。
〔註一〕活的減毒冷適應性(live, attenuated cold-adapted)流感疫苗:由於流感病毒突變種有適於25℃生長的冷適應性,在人體體溫 (36~37℃)無法完善複製,因此可用來開發活的減毒A型和B型流感病毒疫苗,並藉由基因重組以更新病毒循環株的表面抗原。該疫苗有幾個優點:(1)適當減弱的毒性(2)不可傳播性(3)遺傳穩定性(4)冷適應性和溫度敏感性(temperature-sensitive)(5)提供局部和細胞介導免疫反應的免疫原性。根據在嬰兒、孩童、成人及老年人中進行的臨床試驗結果,該疫苗已獲核准上市,易於給藥(可鼻腔投與)的安全性和高效性使其適用於預防所有年齡層的流感。
〔註二〕流感病毒的表面蛋白HA可分為兩個區域,分別為頭部及莖部;HA頭部的抗原變異性高,但是莖部抗原的變異性低、相較頭部穩定。
延伸閱讀
1. Wei CJ et al., Next-generation influenza vaccines: opportunities and challenges, Nat Rev Drug Discov, 2020.
2. Chen JR et al., Better influenza vaccines: an industry perspective, J Biomed Sci., 2020.