- 科技報導
- 焦點話題
文章專區
2024-04-15醫學革命之門開啟!展望首例獲准臨床應用的基因編輯療法Casgevy
508 期
Author 作者
馬荺蒽/臺灣大學生化科技學系四年級生;陳佑宗/臺灣大學基因體暨蛋白體醫學研究所副教授
去(2023)年11月,英國藥品和保健品監管局(Medicines and Healthcare Products Regulatory Agency, MHRA)批准全球首例CRISPR基因編輯療法(簡稱CRISPR療法)——Casgevy(exagamglogene autotemcel, exa-cel),應用於治療12歲以上、有血管阻塞危機(vaso-occlusive crisis, VOC)的鐮刀型紅血球疾病(sickle cell disease, SCD,又稱鐮刀型貧血症)與輸血依賴型乙型海洋性貧血症(transfusion-dependent β-thalassemia, TDT)患者。緊接著,美國食品和藥物管理局(US Food and Drug Administration, FDA)與歐洲藥品管理局(European Medicines Agency, EMA)也相繼通過了該療法的使用,成為CRISPR療法走向臨床應用的重要里程碑。CRISPR療法的旅程可說是近20年生物醫學領域最具創新、革命性的故事。自2012年CRISPR-Cas9技術問世起,短短十年間,CRISPR基因編輯技術如何從學術研究一步步走向臨床治療?此技術未來的發展趨勢又有哪些?
故事的起點-神奇的基因剪刀
故事的起點要回溯到2012年,一個源自於細菌免疫系統的強大基因編輯工具問世,使得簡單、快速又相對精準的基因工程得以實現。
CRISPR-Cas系統原是細菌及古菌對付噬菌體入侵時的防禦機制,科學家們利用此系統運作過程中,Cas蛋白會針對指定DNA序列進行精準雙股切割的特性,結合細胞面臨DNA破壞時啟動的修復機制,研發CRISPR-Cas9基因編輯系統。這個系統僅包含兩個簡單的零件:負責定位的導引RNA(single guide RNA, sgRNA),以及進行切割的剪刀Cas9核酸酶。藉由sgRNA的帶領找到目標DNA序列,Cas9蛋白就能將DNA剪斷,最後再透過細胞修復機制重新黏合斷裂的DNA。
其中,細胞修復機制主要有兩種,第一種是直接將斷裂的DNA兩端拉近並黏合,稱為非同源性末端接合(nonhomologous DNA end joining, NHEJ),雖然效率極高,但過程中可能產生插入/缺失(insertion/deletion, indel),是容易造成基因被破壞的修復方式。另一種則是同源性重組(homology directed repair, HDR),細胞會根據同源等位基因序列或外來指定模板來進行修復,雖然效率較低,但基因較有機會被正確修復(圖一)。
CRISPR-Cas9系統相較於先前發展的基因編輯技術,例如鋅手指(zinc fingers)與TALENs(transcription activator-like effector nucleases)等,不論是在設計或操作上都更為簡單、直接。研究人員只需要設計一條與目標位點相對應的sgRNA,這把神奇的基因剪刀理論上就可以對任何基因進行切割與編輯,以剔除或修改基因。由於CRISPR-Cas9系統大幅降低了基因編輯的技術門檻,不僅引發相關技術的研究熱潮,也成為治癒遺傳疾病的新希望。
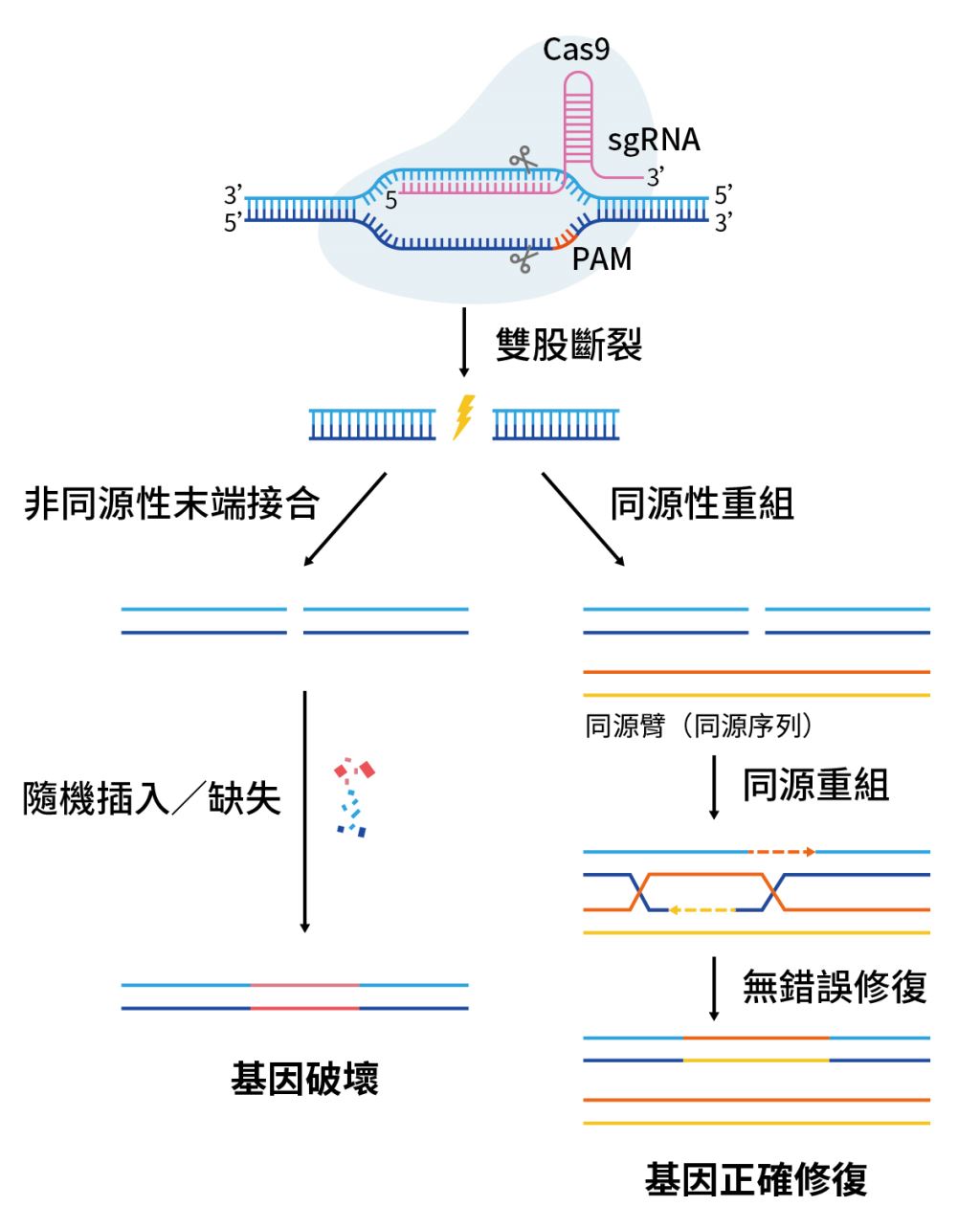
圖一|CRISPR-Cas9作用機制(資料來源:作者提供)
CRISPR療法的探索之旅-從學術研究走向臨床治療
數以千計的人類疾病是由基因突變所引起,但其中許多疾病至今仍未有完善的治療方案,而CRISPR-Cas9系統的出現便提供了絕佳的基因治療平臺。然而,基因剪刀並非萬無一失,潛在的「脫靶效應」(off-target effect)是它的一大隱憂。在臨床治療上,無法控制的脫靶是不被允許的風險,也因此在CRISPR療法走向臨床的道路上,除了解決技術問題外,還需要思考:如何降低技術風險?
有鑑於此,現階段科學家尋找的候選疾病需要具備以下特點:第一,不論在病理學或分子生物學上都被了解透徹,且至今尚未找到有效治療策略的疾病。第二,可以藉由編輯少量細胞產生重大影響。第三,為了降低風險、增加效率,以細胞能透過離體培養(ex vivo)搭配破壞基因序列的方式治療的疾病為首選。經過層層篩選,兩個一直以來備受關注的疾病成為候選,分別是與愛滋病(acquired immunodeficiency syndrome, AIDS)相關的CCR5基因,以及本文主角:與SCD相關的BCL11A基因。
SCD是一種隱性遺傳疾病,主要特徵為紅血球在缺氧環境下易凝聚形成鐮刀狀。這些形狀不規則的紅血球質地較堅硬和黏稠,易造成血管阻塞,導致氧氣無法順利運送至全身。此外,嚴重者還可能出現VOC,引發劇烈疼痛和器官缺氧受損,同時伴隨著中風、骨髓炎等併發症風險。SCD目前唯一能治癒的方法是骨髓移植手術,不僅風險高且只有少數患者(約15%)有合適的基因匹配捐贈者,也因為骨髓移植患者需要承受高劑量化學藥物或全身放射線照射預處理,因此對患者健康程度有一定要求。
幸運的是,美國哈佛醫學院(Harvard Medical School)教授奧爾金(Stuart Orkin)早在多年前就已證實,抑制BCL11A基因可以治療患有SCD的小鼠。現已知的血紅蛋白有兩種,分別是胎兒血紅蛋白(fetal hemoglobin, HbF)和成人血紅蛋白(adult hemoglobin, HbA)。胎兒體內主要的HbF由甲型(α-)與丙型(γ-)球蛋白(globin)組成,在成人體內占絕大多數的HbA則由甲型與乙型(β-)球蛋白組成,而SCD則是由乙型球蛋白基因突變所引起。在一般胚胎發育成人的過程中,BCL11A基因表現會降低丙型球蛋白產量並提高乙型球蛋白濃度,使得胎兒紅血球中HbF的攜氧功能在成人血液中被HbA所取代(圖二)。因此藉由破壞BCL11A基因表現,可回復丙型球蛋白產量並促使細胞生產正常的HbF,進而降低鐮刀型血紅蛋白(hemoglobin S, HbS)濃度,防止紅血球凝聚、避免VOC的發生。由於第一代CRISPR-Cas9系統對於特定序列破壞的效率遠高於精確修復的效率,奧爾金的研究團隊便以BCL11A基因座(locus)轉錄增強子(enhancer)序列作為CRISPR破壞的標靶位點,藉以逆轉發育過程中HbA取代HbF的過程。這些重大發現先後發表於《科學》(Science)和《自然》(Nature)期刊,為後續CRISPR療法研發提供了一份寶貴的藍圖。
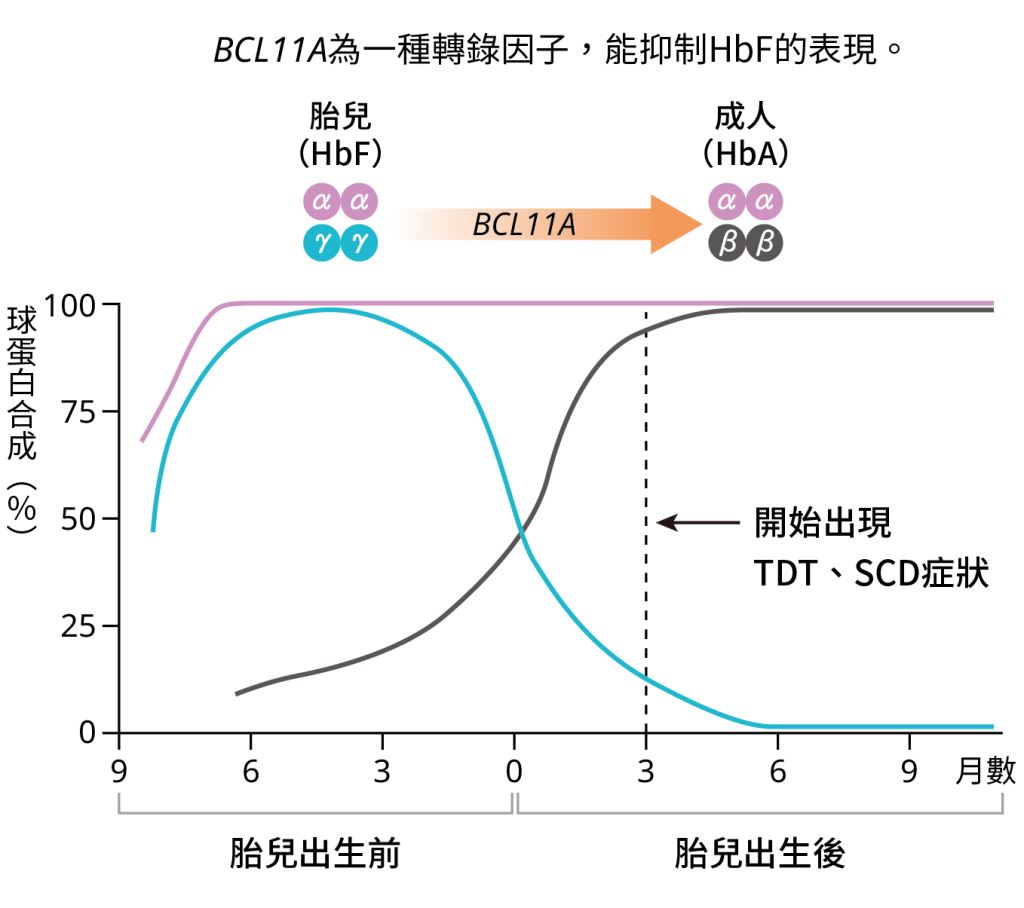
圖二|人體血紅蛋白HbF與HbA調控機制(資料來源:作者提供)
重要里程碑-CRISPR療法首次獲得核准
經過科學家們的努力,由CRISPR Therapeutics與Vertex Pharmaceuticals公司合作生產的CRISPR療法Casgevy終於在去年底誕生。
Casgevy是一種結合自體造血幹細胞(hematopoietic stem cell, HSC)與CRISPR-Cas9離體基因編輯的療法。療程中透過抽取患者骨髓內的HSC,並在體外以CRISPR技術破壞BCL11A基因增強子序列,再將完成編輯的細胞植入骨髓,藉由降低細胞BCL11A表現提高丙型球蛋白的產量,以增加患者體內功能正常的紅血球總數,達到治療SCD的目的(圖三)。臨床實驗數據顯示,44名接受Casgevy治療的患者中,共有31名完成為期兩年的完整追蹤,其中29名(93.5%)患者在治療後至少連續一年VOC不曾發作,且未出現安全性問題。
此外,Casgevy也適用於同樣因乙型球蛋白基因突變所致的TDT,藉由降低BCL11A基因表現提高丙型球蛋白產量、改善甲型與乙型球蛋白不平衡的問題,減少患者對定期輸血的依賴。FDA也已於今(2024)年1月通過Casgevy應用於TDT的治療許可。
這項歷史性的批准不僅帶來SCD、TDT的新型治療方案,也開啟了基因編輯治療的大門。不過CRISPR療法的成功與否仍需通過時間考驗,FDA諮詢委員也建議執行為期15年的上市後安全性追蹤研究,以評估此療法中可能發生的脫靶事件與造成惡性腫瘤的長期風險。截至目前為止,在接受Casgevy治療的患者中並未發現任何脫靶或致癌基因突變。
.jpg)
圖三|Casgevy療程(資料來源:Cure Sickle Cell, NIH)(Image by Freepik)
CRISPR療法下一個挑戰-體內基因編輯
生物技術的發展過程往往漫長而艱辛,科學家們常常需要耗費大量時間才能將學術研究成果應用至臨床治療。以RNA干擾(RNA interference, RNAi)技術為例,艾拉倫製藥(Alnylam Pharmaceuticals)耗費16年的開發才成功推出首款RNAi藥物。相較之下,CRISPR療法在短短十年間便取得重大突破,顯示這項技術在疾病治療的潛力。與此同時,CRISPR療法依然在以意想不到的速度迅速發展。
截至目前為止,已有24個CRISPR藥物進入臨床二期,除了Casgevy使用的自體細胞「離體基因編輯」外,「體內(in vivo)基因編輯」治療臨床試驗也在同步進行(表一)。其中最受關注的候選藥物包含NTLA2001與CTX112、CTX131。NTLA-2001是由Intellia Therapeutics研發,針對罕見甲狀腺素運載蛋白類澱粉沉積症(transthyretin amyloidosis, ATTR)的CRISPR療法,並已於去年10月獲得FDA核准進行臨床三期試驗,這也是FDA核准的第一項「體內基因編輯」關鍵性試驗。而由CRISPRTherapeutics研發的CTX112、CTX131,則是以CRISPR-Cas9為平臺的同種異體CAR-T細胞療法,有望成為自體免疫疾病與癌症的新治療策略。
然而,由於第一代CRISPR-Cas9對目標位點進行雙股切割後,往往是經由NHEJ修復,進而導致基因序列遭破壞、基因功能喪失,若要針對罕病中常見的隱性遺傳基因突變進行單點的精確基因修復,它的編輯效率並不十分理想。對此,新發展的基因編輯工具或許能提供解決之道。
鹼基編輯(base editing, BE)與先導編輯(prime editing, PE)是以第一代CRISPR-Cas9為基礎,延伸而來的新世代基因編輯工具,又被稱為CRISPR2.0。由於此兩者皆使用只會切割單股的解旋酶(Cas9 nickase, nCas9),因此在編輯過程不會形成雙股斷裂,從而提高編輯精準度並降低癌變風險。前者BE是藉sgRNA及nCas9標的特定基因座,再利用去胺酶(deaminase)活性在特定序列區間將A改為G或C改為T,來達成相對精確、安全的單點基因修復。在前十大基因編輯治療生技公司中,Beam Therapeutics與Verve Therapeutics正是以BE為主要的編輯平臺。而PE則是利用反轉錄酶(reverse transcriptase)活性,依據預先設計帶有反轉錄模板的sgRNA(稱為pegRNA),對特定基因點位進行編修,這不僅突破了BE無法形成顛換突變(transversion mutation)的瓶頸,更具有能在短序列內精準編輯(包含插入、刪除、各式鹼基置換)的優勢。但因發展PE技術的Prime Medicine起步較晚,目前尚未進入臨床試驗階段。值得注意的是,這兩項跨世代基因編輯技術皆出自臺裔美國籍哈佛大學教授劉如謙(David Liu)的研究團隊,BE成為他2017年入選《自然》期刊全球十大科學人物(Nature's 10)的關鍵,而PE的研發則入選2019年度十大傑出論文。
表一|CRISPR療法進入臨床二期的試驗藥物案例(資料來源:作者提供)
| 適應症 |
試驗公司 |
計畫編號 |
臨床試驗階段 |
平臺 |
方法 |
臨床試驗編號 |
| 遺傳性疾病(genetic disorders) |
| 甲狀腺素運載蛋白類澱粉沉積症(transthyretin amyloidosis, ATTR) |
Intellia Therapeutics |
NTLA-2001 |
Phase III |
CRIPSR-Cas9 |
in vivo 基因治療 |
NCT06128629 |
| 遺傳性血管性水腫(hereditary angioedema, HAE) |
NTLA-2002 |
Phase I/II |
NCT05120830 |
| 第一型糖尿病(type I diabetes mellitus) |
CRISPR Therapeutics |
CTX211 |
Phase I/II |
ex vivo 基因治療 |
NCT05565248 |
| 心血管疾病(cardiovascular disease) |
CTX310 |
Phase I |
in vivo 基因治療 |
|
| CTX320 |
| 異 合 子 家 族 性 高 膽 固 醇 血 症(high-risk heterozygous familial hypercholesterolemia, HeFH) 和 動 脈 粥 狀 硬 化 心 血 管 疾 病 (atherosclerotic cardiovascular disease, ASCVD) |
Verve Therapeutics |
VERVE-101 |
Phase Ib |
Base Editor |
in vivo 基因治療 |
NCT05398029 |
| 感染性疾病(infectious diseases) |
| 人類免疫缺乏病毒(human immunodeficiency virus, HIV)感染 |
Excision Biotherapeutics |
EBT-101 |
Phase I/II |
CRIPSR-Cas9 |
in vivo 基因治療 |
NCT05144386 |
| 具抗藥性大腸桿菌(Escherichia coli)引發的泌尿道感染(urinary tract infections, UTIs) |
Locus Biosciences |
LBP-EC01 |
Phase II/III |
噬菌體治療 |
NCT05488340 |
| 具抗藥性的大腸桿菌感染 |
SNIPR Biome |
SNIPR001 |
Phase I |
噬菌體治療 |
NCT05277350 |
| 癌症(cancer) |
| 復發/難治型 B 細胞淋巴癌(relapsed/refractory B-cell malignancies) 和自體免疫性疾病(autoimmune disease) |
CRISPR Therapeutics |
CTX112 |
Phase I/II |
CRIPSR-Cas9 |
CAR-T 細胞治療 |
NCT05643742 |
| 血液惡性疾病(hematologic malignancies)和實質固態瘤(solid tumor) |
CTX131 |
NCT05795595 |
| 復發/難治型 T 細胞急性淋巴性白血病(T-cell acute lymphoblastic leukemia, T-ALL)和 T 細胞淋巴性淋巴瘤(T-cell lymphoblastic lymphoma, T-LBL) |
BEAM Therapeutics |
BEAM-201 |
Phase I/II |
Base Editor |
NCT05885464 |
| 復發/難治型急性骨髓性白血病(acute myeloid leukemia, AML) |
Caribou Biosciences |
CB-012 |
Phase I |
Cas12a chRDNA |
NCT06128044 |
未知的結局-CRISPR療法未來發展趨勢
綜合上述,CRISPR療法可以說是當代最具潛力的醫學發展之一。相對於目前世界主流的小分子藥物和生物製劑(抗體藥物),CRIPSR療法可以針對基因組的特定區域進行編輯,實現個人化精準醫療,只需要有合適的標靶序列,便能應用於各種疾病。最重要的是,CRISPR療法有機會根治疾病,令患者不需長期服用藥物,進一步改善生活品質。
最後,在CRISPR技術蓬勃發展的同時,合格的治療中心和相應的法規調整與支持也是CRISPR療法成功不可或缺的一環。無論如何,CRISPR療法首次獲得FDA核准臨床使用不僅為醫學界開啟了新時代,也為過去認為無法醫治的罕見遺傳性疾病帶來了新希望。

(Adobe Stock)
延伸閱讀
1. Esrick, E.B., et al. (2021). Post-transcriptional genetic silencing of BCL11A to treat sickle cell disease. New England Journal of Medicine, 384(3), 205-215.
2. Frangoul, H., et al. (2021). CRISPR-Cas9 gene editing for sickle cell disease and β-thalassemia. New England Journal of Medicine, 384(3), 252-260.
3. Li, T., et al. (2023). CRISPR/Cas9 therapeutics: progress and prospects. Signal transduction and targeted therapy, 8(1), 36.