- 封面故事
- 2013年
- 524期-動作電位六十年(8月號)
文章專區
2013-08-01窺探動作電位的離子通道基礎
524 期
Author 作者
王瀚潁/台灣大學動物學研究所博士。
真核細胞(植物、動物、真菌、黏菌、原生動物及藻類)的結構宛如一個有秩序的工廠,其由細胞膜、細胞質及許多複雜的胞器所組成。細胞膜的厚度約6~10奈米(nm)厚,主要由磷脂質及蛋白質構成的雙層結構,亦具有與磷脂質或蛋白質相連結的碳水化合物結構。細胞膜將細胞與外在環境隔離,賦予細胞個體性,但細胞膜並非只是個不可通透的隔離層。細胞膜上具有特定蛋白質組成的通道(channel)以及幫浦(pump),是具有高度選擇性及滲透性的隔離層。除了有與外界作物質交換的管道外,細胞膜亦具有接收外界刺激的特定接受器(receptor),如細菌可以向食物的位置移動、賀爾蒙只能對特定細胞發揮作用等等,都是膜上的特定接受器接收到外界訊號所導致。有些特化的細胞膜會產生化學或電訊號(如神經動作電位傳導),因此細胞膜在生物訊號的傳達與交流上扮演了首要的角色。由於離子及極性分子不能直接通過細胞膜的雙層脂質,故必須藉助上述所提的通道或幫浦這兩種蛋白質的幫忙。通道能使離子快速地順著電化學濃度梯度的方向穿透細胞膜。相反的,幫浦則能用光或ATP 等物質作為能量來源,來幫助離子或極性分子逆著梯度方向穿透細胞膜。
神經細胞,又稱神經元(neuron),是構成神經系統結構和功能的基本單位。神經元傳遞訊息的方式主要是藉由產生動作電位(action potential),沿著軸突傳遞到下一個神經元。1952年,兩位英國生理學家霍奇金和赫胥黎,以烏賊的巨大神經軸突為材料,闡述了動作電位是因為細胞膜對於鈉及鉀離子的通透性發生了短暫且巨大的改變所造成。他們因此也提出神經元細胞膜上具有兩種不同離子通道的假設,其中一種只能讓鉀離子通過,而另一種只能讓鈉離子通過(詳見本期嚴震東教授文)。然而,霍奇金和赫胥黎的研究引出了三個有關離子通道重要的問題:(1)鈉離子通道對鈉離子的通透性是鉀離子的11倍,而鉀離子通道對鉀離子的通透性則是高於鈉離子100倍以上,這些離子通道對於離子的篩選能力(ion selectivity)是如何辦到的?(2)離子通道是如何感應到神經元細胞膜電位的變化,進而改變離子通過細胞膜的量?(3)為什麼神經元在產生動作電位狀態下,鈉離子通道會自動關閉?且當恢復到靜止膜電位狀態下鈉離子通道又可以因電位的改變而開啟?這些問題因著細胞膜箝制紀錄(patch-clamp recording)的技術發明,而逐漸得到解釋。
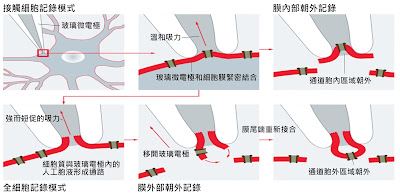
圖一:神經細胞膜箝制技術。電極與細胞膜接觸後形成高電阻密封狀態,稱為接觸細胞記錄模式。
若在此時將與電極接觸的細胞膜吸破後,則形成所謂全細胞記錄。觀測單一離子通道的特性時,則分別有膜內朝外及膜外朝內兩種記錄方式。
在1970年代初期,許多科學家試著將玻璃微電極插入細胞內作細胞內記錄(intracellular recording),雖然這個技術可記錄到神經元的電壓變化或動作電位,但因為電極與細胞膜之間的間隙過大造成漏電現象,再加上記錄過程中過大的雜訊干擾,因而無法記錄到神經細胞真實的電流狀況。1976年,德國的兩名生理學家內爾(Erwin Neher)和薩克曼(Bert Sakmann)發明了細胞膜箝制記錄技術,因而使得離子通道的研究有了革命性的發展,他們也因為這項重大發明而獲得1991 年的諾貝爾生理醫學獎。他們將一根尖端口徑約為1微米(μm)的乾淨玻璃微電極注入人工細胞內液後,輕輕壓在神經細胞表面,此時若給予一細微的負壓將神經細胞吸住,玻璃微電極的開口便會與神經細胞膜緊密的黏合在一起,這使得玻璃微電極內部的人工細胞內液與細胞外液之間的電阻值高達幾個gigaohm(1 gigaohm = 109 ohm,ohm為電阻單位「歐姆」)。在這樣的狀況下所記錄到的電流並不會從電極開口與細胞膜接觸的間隙外洩,也阻絕了外在雜訊對記錄過程中的干擾,故提高了測量時的訊號雜訊比(signal-to-noise ratio)及精確度,因此我們能得到高解析度的量測值。
細胞膜箝制技術可以隨著實驗設計的不同而有不同的類型,當玻璃微電極和神經元上一小塊細胞膜接觸後,形成高電阻密封狀態(gigaseal),我們稱此類型為接觸細胞記錄模式(cell-attached)。雖然接觸細胞記錄模式是最接近生理狀況的紀錄方式,但由於沒有將玻璃微電極接觸的那一小塊細胞膜吸破,使得我們沒辦法操控神經細胞的電壓或電流,因而無法得知神經元細胞膜上離子通道更詳細的行為。然而當我們在接觸細胞記錄模式下給予玻璃微電極一短促的負壓時,那一小塊細胞膜就會被吸破,因此細胞質就會與玻璃微電極內的人工細胞內液相通成為一個通路。在這種稱之為全細胞記錄模式(whole-cell)模式中,我們就可以測量到神經元細胞膜上所有離子通道的整體變化趨勢了。另一方面,假如在接觸細胞或全細胞記錄模式下,將玻璃微電極拉離開細胞,將可以製備出一小片處於小塊膜記錄模式(excisedpatch)的細胞膜,在此模式下的細胞膜可以呈現出細胞膜內部朝外或細胞膜外部朝外的狀態,但不論是哪一種狀態皆可透過玻璃微電極來記錄這一小塊細胞膜上離子通道的活性變化。……【更多內容請閱讀科學月刊第524期】