- 專欄
文章專區
2022-03-03誘發中和抗體、活化記憶型淋巴球?疫苗與狡猾病毒間的攻防戰
627 期
Author 作者
蔣維倫/泛科學PanSci專欄作家、故事專欄作家、udn鳴人堂專欄作家、前國衛院衛生福利政策研究學者。喜歡虎斑、橘子、白底虎斑和三花貓。
Take Home Message
•冠狀病毒使用其表面的棘蛋白做為鑰匙,進而感染細胞。若能以「棘蛋白」做為疫苗抗原,可誘發出中和性抗體。為了誘發出高效抗體,疫苗中的抗原應為天然、完整的蛋白質,維持正確的立體結構。
• 由於病毒、細菌、寄生蟲等,都有一些獨有且在人體內鮮少出現的模式,例如細菌的細胞壁、雙股RNA等病原體相關分子模式。當抗原呈現細胞的模式識別受體,接收到病原體相關分子模式的訊號時,就會拉響警鈴,並將抗原呈現給淋巴球。
• 由於基因型疫苗本體,就自帶佐劑的性質,例如腺病毒疫苗的載體為病毒顆粒、表面有病毒蛋白;而mRNA疫苗內含的單股RNA,也能刺激模式識別受體,因此該類型的疫苗,不需另外添加佐劑也能仿造出「敵襲」的訊號,但蛋白質類型疫苗缺乏此類特質,因此必須使用佐劑。
在《科學月刊》第626 期〈怎麼設計出一支疫苗?先從了解人體內的免疫機制開始〉一文中,我們介紹了人體免疫系統裡白血球的簡要工作流程。那麼,為了要達到疫苗的兩大目標:誘發中和性抗體、活化記憶型淋巴球產生,一支合適的疫苗該怎麼設計呢?
疫苗的目標
疫苗設計通常從兩個層面切入,分別是抗原與佐劑。接下來我們就以2019 冠狀病毒疾病(COVID-19)的疫苗做為範例,進行說明。
抗原的設計-誘發中和性抗體
理論上,病毒都是仰賴其表面蛋白質,結合特定細胞受器、侵入細胞。但疫苗科學家面對全新的病毒時,還須思考「用哪個蛋白質當抗原?」、「用什麼結構?」、「產生抗體的效益如何?」、「該結構穩定嗎?」等問題。因此新疾病疫苗的設計前期,通常需要大量的基礎研究,極為耗日廢時。
而COVID-19 疫苗能在一年內開發完成,必須歸功於科學家們的未雨綢繆。早在2003 年的嚴重急性呼吸道症候群(SARS) 疫情中, 由SARS 冠狀病毒引起的嚴重急性呼吸道疾病,造成世界重創;直到2012 年,中東再次出現高致命性的中東呼吸症候群冠狀病毒感染症(MERS)後,科學家深恐未來會再出現第3 種威脅人類的未知冠狀病毒,因此開始累積對冠狀病毒家族的基礎研究。他們發現,冠狀病毒都使用表面的棘蛋白(spike protein)做為鑰匙,打開細胞受器,進而感染細胞。換言之,若以棘蛋白做為疫苗抗原,便可誘發出中和性抗體〔註〕。
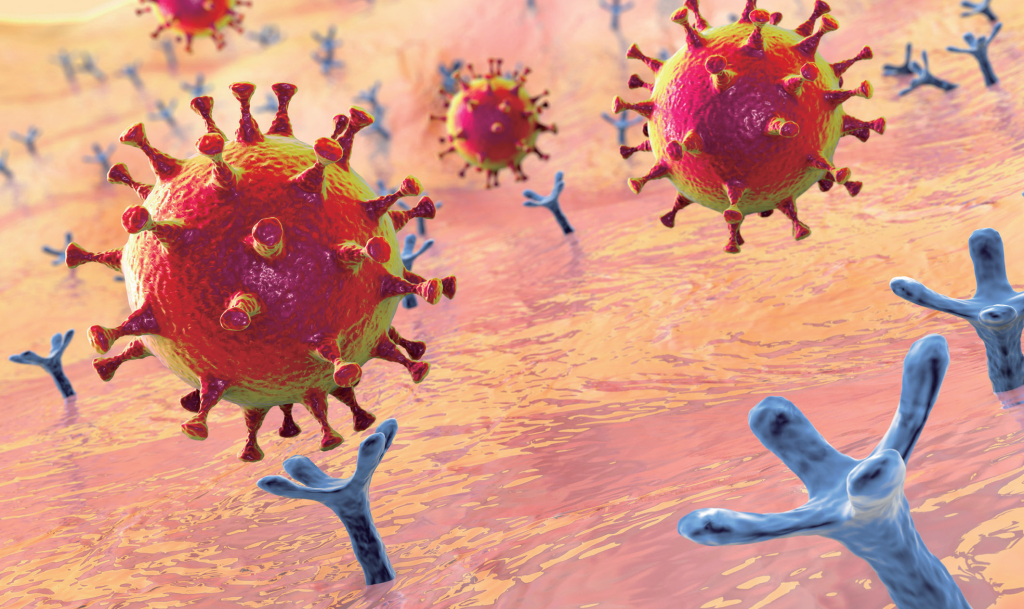
新型冠狀病毒(SARS-CoV-2)表面插滿了棘蛋白,當棘蛋白結合細胞表面的膜蛋白「血管收縮素轉化酶2」(ACE2)後,
就會導致細胞吞入病毒、進而遭受感染。(123RF)
〔註〕因為國產聯亞疫苗的抗原,僅採用冠狀病毒棘蛋白、膜蛋白、核衣蛋白的部分胜肽碎片,並非使用完整的病毒棘蛋白,故可猜測因此導致該疫苗產生的中和性抗體效價過低。
不過抗原該如何成功結合B細胞的表面受體(B-cell receptor),並誘發抗體呢?關鍵在於抗原的立體結構。因此旨在誘導高濃度中和性抗體的疫苗,例如COVID-19、破傷風,內含的抗原應保持天然、完整的蛋白質,以維持正確的立體結構,才能誘發出高效的中和性抗體。
而科學家進一步發現,棘蛋白在病毒的生命週期裡,會有多種結構型態,有些型態會自然形變甚至水解。而誘發抗體效果最好的結構,就是棘蛋白融合前(prefusion conformation)的結構。因此建議未來的疫苗學家,若想使用完整的棘蛋白做抗原,可以微調胺基酸,讓棘蛋白保持該結構,以發揮最大的誘導能力。
莫德納(Moderna)、高端等藥廠,都依循當年科學家的建議,不僅挑選完整的棘蛋白做為疫苗抗原,更微調胺基酸〔註〕,讓棘蛋白保持在誘導能力最強的結構。
〔註〕因為通常微調胺基酸時,都將第986號位的離胺酸(lysine, K)和第987號位的纈胺酸(valine, V)都改成脯胺酸(proline, P),故被簡稱為S-2P。
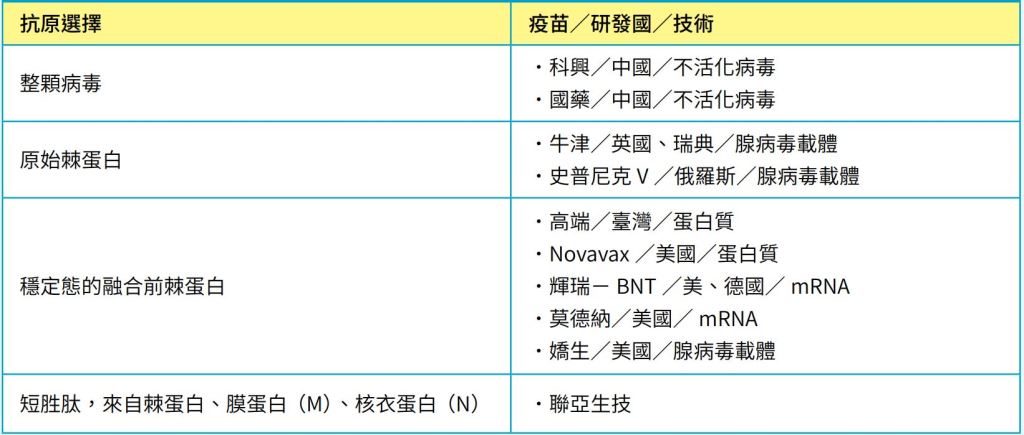
表一|COVID-19疫苗的抗原策略
佐劑的設計-拉響警報、欺騙抗原呈現細胞
即使抗原設計的再好,若不能拉響警報,抗原呈現細胞(antigen-presenting cell, APC)也不會通知淋巴球。
抗原呈現細胞都平常保持在「搜索」狀態,它們會在身體裡四處遊蕩,吞下各種分子,但不會跑回淋巴結刺激T細胞,以避免「誤拉警報」,造成T細胞攻打自身組織的自體免疫疾病。由於病毒、細菌、寄生蟲等,都有一些獨有的固定模式,且是在人體內鮮少出現的特徵,例如細菌的細胞壁、雙股RNA等,此類特徵被稱為「病原體相關分子模式」(pathogen-associated molecular patterns, PAMP)。而抗原呈現細胞的表面、體內,有著多樣的模式識別受體(pattern recognition receptors, PRR),能夠接收不同的病原體相關分子模式訊號,以拉響警鈴。
當抗原呈現細胞遇到上述提及的「戰爭」線索,或理論上「只發生在人體被破壞、壞死」時會出現的尿酸、ATP等,就會轉變為呈現狀態,開始朝著淋巴結移動,並轉化為具有活化T細胞的能力。因此疫苗的目的就是要仿造「敵襲」訊號,讓抗原呈現細胞從「搜索」轉變為「呈現」狀態,再將肚子裡的抗原吐出、呈現給淋巴球們。
在COVID-19疫苗群中,可以看到mRNA疫苗、腺病毒疫苗等基因型疫苗,皆未提及佐劑;但蛋白質類型疫苗,例如高端、Novavax,都刻意強調佐劑的說明。這是因為基因型疫苗本體,就自帶佐劑的性質(self-adjuvanted),例如腺病毒疫苗的載體就是病毒顆粒、表面有病毒蛋白;而mRNA疫苗內含的單股RNA,也能刺激模式識別受體,因此該類型的疫苗,不需另外添加佐劑也能仿造出「敵襲」的訊號。
但蛋白質類型疫苗缺乏此類特質,因此必須用佐劑仿造「敵襲」。佐劑依目的使用可分為3類:
• 讓局部組織發炎/受損(damage-associated molecular patterns-type adjuvants),例如鋁鹽、皂苷(saponin)
• 模仿病原體入侵訊號(pathogen-associated molecular patterns-type adjuvants),例如未甲基化的CpG序列DNA、雙股RNA
• 讓白血球更有效地捕獲疫苗(particulate adjuvants):製備成類似病毒的奈米顆粒,以利淋巴系統捕捉
COVID-19的mRNA疫苗、腺病毒疫苗等基因型疫苗內含的單股RNA就自帶佐劑的性質,能刺激模式識別受體,因此不需另外添加佐劑也能仿造出「敵襲」的訊號;而蛋白質類型疫苗,例如高端、Novavax,則會強調佐劑的說明,例如腺病毒疫苗的載體就是病毒顆粒、表面有病毒蛋白。(123RF)
因為模式識別受體的活化,能影響抗原呈現細胞活化後續的T細胞,因此不少現代疫苗設計時會使用複數類型的佐劑,以期達到最佳的功效。部分COVID-19疫苗採用的佐劑如下:
• mRNA疫苗(例如莫德納疫苗、輝瑞-BNT):mRNA即有佐劑特性,無須無須外加佐劑
• 腺病毒載體(例如AZ疫苗、嬌生疫苗):腺病毒的顆粒、表面,內含的DNA即有佐劑特性,無須外加佐劑
• 高端疫苗:鋁鹽、CpG
• Novavax疫苗:皂苷,並將棘蛋白釘在仿似病毒的奈米顆粒
複雜的免疫學-人類開發疫苗的障礙
行文至此,疫苗的免疫學似乎已經完整了?事實上,還差遠了。
複雜的T細胞們
前述文章僅敘及輔助T細胞(Th),但事實上當抗原呈現細胞釋出細胞激素(cytokine)因子,輔助T細胞因此而活化後,可再細分為多種活化路徑,產生多種子細胞,包含Th1、Th2、Th17、Tfhs細胞等。而Th1細胞可加強巨噬細胞的吞噬效果;Th2能提高IgE抗體分泌、引發過敏反應;Tfhs細胞則是能刺激B細胞分泌IgG抗體等。
在呼吸道疾病的疫苗開發裡,曾出現疫苗活化偏向Th2細胞。因此接種者在遇到病毒後,活躍的Th2輔助T細胞、誘發了過敏反應,讓肺部出現發炎、浸潤,導致嚴重的肺損傷。因此現今開發呼吸道疾病疫苗時,都會在動物試驗裡分析輔助T細胞的活化路徑,盡可能地避免走Th2細胞路徑。
但目前科學家對T細胞依舊不夠清楚,雖然在分子層級上,已確認某些細胞因子能誘導特定的走向,例如介白素-12(IL-12)可以活化Th1細胞、介白素-4(IL-4)則能活化Th2細胞等,但放大到動物或人體的層級裡,仍難以確定何種關鍵因素、 添加何種佐劑、劑量多寡?能決定輔助T細胞的活化路徑。
現行推測病原體相關分子模式的種類可能有影響。例如已知脂多醣(lipopolysaccharide, LPS)、CpG的DNA,其活化輔助T細胞都偏向Th1路徑 〔註〕。而抗原呈現細胞活化T細胞的強度、時間,似乎也會影響活化路徑。由於科學家對T細胞的複雜度仍有太多未知,因此未來若又需要開發新興疾病的疫苗時,仍必須在一片迷茫中摸索。
〔註〕因此高端的COVID-19疫苗以CpG為佐劑,除強化疫苗外,亦希望能最佳化T細胞反應。
輔助T細胞活化後,可再細分為多種活化路徑,產生多種子細胞,包含Th
1、Th
2、Th
17、Tfhs細胞等。其中Th
2路徑能提高IgE抗體分泌、引發過敏反應。在過往呼吸道疾病的疫苗開發裡,曾出現疫苗活化偏向Th
2細胞,使得接種者在遇到病毒後,活躍的Th
2輔助T細胞、誘發了過敏反應,讓肺部出現發炎、浸潤,造成嚴重的肺損傷。(123RF)
狡猾的病毒們
僅管疫苗發展已數百年,但面對神乎其技的病毒們,人類仍是力薄無知的那方。
我們都知道RNA病毒善於突變,但C型肝炎和人類免疫缺乏病毒(human immunodeficiency virus, HIV),似乎將升級後的點數全押到突變技能上了。它們表面的蛋白質極度容易突變,不同患者之間——甚至是同一位病人體內——的病毒表面蛋白質都不盡相同。高度多樣化的表面蛋白質,使科學家難以判斷,應該採用哪種蛋白質做為抗原,才能發揮疫苗的功效。
而流行性感冒疫苗又是另一種問題。由於每年秋冬流行的病毒株都不一樣,而疫苗生產至少需要6個月。若年初預測的判斷,和實際流行的病毒株差距甚大,那麼當年的流感疫苗保護力可能就會過低,有爆發流行的危機。
至於而能導致子宮頸癌的人類乳突病毒(human papillomavirus, HPV),則是群深謀遠慮的傢伙。人類乳突病毒在感染細胞後,並不會殺死細胞,這些被病毒感染的殭屍細胞仍保持完整,所以細胞內的尿酸、ATP等不會外洩。因此抗原呈現細胞在 缺乏「敵襲警報」的情況下,不會從「搜索」轉變 為「呈現」狀態,也不會跑回淋巴結搖醒T細胞。所以人類乳突病毒可以持續、長年地感染子宮頸細胞,進而誘發子宮頸癌。儘管科學家開發了預防用的HPV疫苗,但對於已感染、侵入細胞內的人類乳突病毒,我們仍無計可施。
僅管在COVID-19疫苗裡,科學似乎取得了全面勝利。但在大自然面前,人類仍應當居安思危、未雨綢繆。猶如當年的科學家,猜測未來可能有第3次的新興冠狀病毒瘟疫一樣。因此扎實地從基礎研究打起,我們才能在一年之內開發出高效的COVID-19疫苗。我們也應踏著本次疫情裡獲得的各項新技術,認真地厚植基礎研究,以幫助子孫們面對下一場可能發生的大規模傳染病。
延伸閱讀
1. Wim Jiskoot et al., Vaccines. In: Crommelin D., Sindelar R., Meibohm B. (eds) Pharmaceutical Biotechnology, Springer, Cham, 2019.
2. John R. Teijaro & Donna L. Farber, COVID-19 vaccines: modes of immune activation and future challenges, Nature Reviews Immunology, Vol. 21: 195–197, 2021.
3. Andrew J. Pollard & Else M. Bijker, A guide to vaccinology: from basic principles to new developments, Nature Reviews Immunology, Vol. 21: 83–100, 2021.