- 科技報導
文章專區
2021-12-14對抗所有冠狀病毒的口服藥誕生了嗎?從輝瑞的帕克洛維談起
480 期
Author 作者
蔣維倫/泛科學PanSci專欄作家、故事專欄作家、udn鳴人堂專欄作家、前國衛院衛生福利政策研究學者。喜歡虎斑、橘子、白底虎斑和三花貓。
科學裡沒有超級英雄,我們都是站在前人的肩膀上
2002年,香港爆發SARS疫情;2004年,科學家就申請了一款冠狀病毒蛋白酶藥物的專利(WO2005113580A1)。孰料,SARS就此消失無蹤,該藥物在人身上派不上用場,後續轉為治療貓冠狀病毒(feline coronavirus,FCoV)的藥物。時光流轉,15年後2019冠狀病毒疾病(COVID-19)襲來,人類在覆滅之際想起了這款寵物藥物。
今(2021)年10月5日,繼默沙東(Merck)的「莫納皮拉韋」(Molnupiravir)之後,輝瑞藥廠(Pfizer)發表了可用於COVID-19的口服藥帕克洛維(Paxlovid)就是前敘藥物的延伸研究,輝瑞在新聞稿宣稱其抗重症療效將近九成。高超的療效振奮人心,有望成為首批口服藥物之一。
在輝瑞、默沙東推出口服藥物之前,醫界認可治療COVID-19的方式僅能藉助有靜脈注射藥物如:單株抗體、瑞德西韋(Remdesivir)等。但靜脈給藥、必須讓病人住院,倘若治療手段僅有靜脈注射,勢必大幅增加醫護負擔、降低病人的服從性。
因此對於COVID-19此類全球性流行病而言,口服藥物的出現,代表病人能在家自行服藥,減輕醫療負擔、提高病人遵從性。更提供了曝露前保護(如:前往隔離病房或嚴重疫區前開始吃藥)、曝露後預防(如:和確診者接觸的5天內,立刻吃藥)的策略選項。
那麼,輝瑞的口服藥為什麼有效?帕克洛維的運作機制和瑞德西韋、莫納皮拉韋有什麼差別嗎?
從冠狀病毒生活史 看帕克洛維的作用機制
在說明輝瑞的帕克洛維抗病毒機制之前,我們先簡單了解一下冠狀病毒的生活史,其步驟依序如下:
1. 病毒接觸細胞表面受器、進入細胞
2. 病毒釋出內藏的RNA基因,轉譯出大段的病毒蛋白質等
3. 病毒蛋白酶切割大段的病毒蛋白質,切出有功能的蛋白質
4. 病毒的RNA聚合酶持續複製新RNA
5. RNA基因持續轉譯出新結構性病毒蛋白
6. 新RNA基因、結構性病毒蛋白組裝成新病毒,再離開細胞
帕克洛維主要阻斷步驟3病毒結構蛋白質的出現,因此以下我們將對該步驟做詳細說明。冠狀病毒是單股正鏈RNA病毒,進入宿主細胞、釋出病毒顆粒內的RNA後,會利用人體細胞的核醣體轉譯出兩條多肽鏈pp1a和pp1ab。此兩條多肽鏈是多個非結構性蛋白(non-structural protein, NSP)的前驅物組合,在後續的步驟中,會被病毒蛋白酶切開,就能協助病毒複製子代。
當非結構性蛋白被正確地切開後,會分頭行動。有的負責停止人體細胞正常轉譯,並促使分解人體mRNA;有些會利用病毒RNA為模版、開始複製更多的新RNA,其中最重要的為RNA依賴性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)——nsp12。換言之,若能阻止「切開」的步驟,就能阻止非結構性蛋白出現、進而扼殺病毒的複製流程。打個比方,還未經切割摺疊的多肽鏈,就像是一塊很大張的西裝布料,上面用粉筆繪著剪裁線。而病毒蛋白酶能辨認剪裁線、逐一切下,裁切後的布料就能進一步縫合成西裝外套、褲子等,也就是在後續的步驟中形成正確、具有功能的蛋白質。若能打壞剪刀,那麼布料就無法成為有功能的產品了。
那麼,是哪些蛋白酶負責正確地切開多肽鏈呢?病毒產生的兩條多肽鏈內都各包含2個蛋白酶,分別是3CL蛋白酶(3C-like protease)和PL蛋白酶(papain-like protease)。因為帕克洛維是阻斷3CL,故以下將主要敘述3CL蛋白酶的運作機制。
3CL和PL蛋白酶是兩條多肽鏈的其中一部分(圖一),而整個「切開」的過程、就從兩個蛋白酶的自我裁切開始。3CL和PL會將自己從pp1a和pp1ab裡切出來,然後3CL將負責11個裁切處,而PL則辨識3個裁切處,陸續地切出其他的非結構性蛋白,讓它們去劫持細胞、複製病毒基因等。
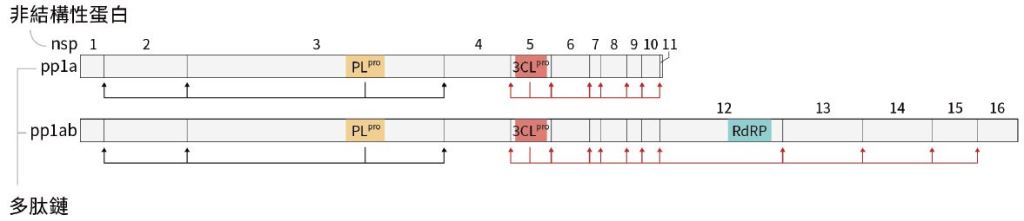
圖一:SARS-CoV-2 的pp1a 和pp1ab 兩條多肽鏈、其nsp(僅標註3CL、PL、RdRp)。紅色箭頭代表被3CL 辨認、裁切的位置,黑色箭頭代表被PL 辨認、裁切的位置。
冠狀病毒的非結構性蛋白,對病毒存活非常重要。其中最重要的是,多個非結構性蛋白會組裝成複製酶和轉錄酶複合物 (replicase–transcriptase complex, RTC),該複合物協助複製RNA病毒基因,也協助產出其他病毒蛋白的RNA、進而強而我們已知,主要負責切出非結構性蛋白的蛋白酶是3CL,所辨認、切除的胺基酸序列都是Leu-Gln↓Ser-Ala-Gly(↓記號為切割位點),蛋白酶3CL似乎專門辨認、切割該序列Gln之後的多肽鏈。因此模仿被辨認、切割的結構、進而製成小分子藥物,就有可能讓蛋白酶誤食藥物、進而失去活性。
科學家對多種冠狀病毒,包括SARS-CoV-2、SARS-CoV、MERSCoV的3CL蛋白酶進行X光晶體結構的分析,發現它們之間具備高度結構相似性和保守性。若能開發出針對3CL的小分子藥物,就有機會延伸成對抗現在舊有、未來新興冠狀病毒的廣譜型藥物。而更重要的是,目前研究上,尚未發現人類體內有著相同特性的酵素;換言之,該藥物有可能不會誤傷人體、造成嚴重副作用。綜上所述,針對3CL的小分子藥物,也許是人類心目中最理想的抗冠狀病毒藥物。
類似的設計概念,已在其他病毒上使用,如:人類免疫缺陷病毒(human immunodeficiency virus,HIV)和C型肝炎病毒(hepatitis C virus, HCV),都已有各自對應的蛋白酶抑制劑藥物上市使用。
模仿布料的裁切線:抑制冠狀病毒3CL蛋白酶
輝瑞的帕克洛維,內含兩種藥物,分別為新藥PF-07321332和老藥利托那韋(ritonavir)。PF-07321332是3CL蛋白酶抑制劑,而利托那韋可抑制人體正常酵素,避免PF-07321332過快被人體代謝,已被應用在抗HIV等治療。
在十數年前,香港爆發2002年的SARS疫情後不久,輝瑞的科學家就透過模仿被3CL蛋白酶辨識、切割的多肽鏈特徵(即前述模仿Leu-Gln↓Ser-Ala-Gly的結構),設計出第一代3CL蛋白酶抑制劑:PF-00835231。然而,SARS就此消失人間,此化合物的研發、應用轉向寵物領域,最後成為治療貓冠狀病毒引發腹膜炎(feline infectious peritonitis, FIP)的藥物(GC-376)。制宿主細胞製造病毒蛋白質。
世事難料,去年由全新的冠狀病毒所爆發的COVID-19襲向人類,全球的科學家傾力對抗。PF-00835231和GC-376也被加入測試中,結果發現它們都能阻斷SARS-CoV-2存活,顯示開發3CL蛋白酶抑制劑的方向正確。
科學家再逐步微調化合物的結構、以改善口服生物利用率、製程友善性等。透過不斷測試,其口服生物利用率,從PF-00835231的1.4%,拉高到PF-07321332的50%。
PF-07321332屬於可逆、競爭型酵素抑制劑,透過模仿病毒多肽鏈的特徵,讓3CL蛋白酶誤食,因此若有足夠濃的藥物,就能和多肽鏈競爭、讓3CL蛋白酶咬不到真正的多肽鏈。而PF-07321332的腈基(nitrile)會和蛋白酶結合成可逆的共價鍵,等同於黏住蛋白酶的嘴巴,進一步阻止3CL蛋白酶正常的工作。
以圖二為例,該圖的4個抑制3CL蛋白酶的化合物,其P1支鏈的設計以γ-lactam模仿Gln胺基酸, 而P 2支鏈設計以疏水性的環丁烷(cyclohexyl)或環丙烷(cyclopropyl)基團模仿白胺酸(Leucine, Leu)。而設計成彈頭(warhead)的官能基,可和3CL蛋白酶的活性位置形成共價鍵、卡住蛋白酶。其中PF-07321332符合高口服生物利用率、藥廠製程友善度佳,同時也在細胞實驗裡展現出抗病毒的效果,於是輝瑞將此化合物投入人體的臨床試驗,力求盡速推出COVID-19口服藥物。
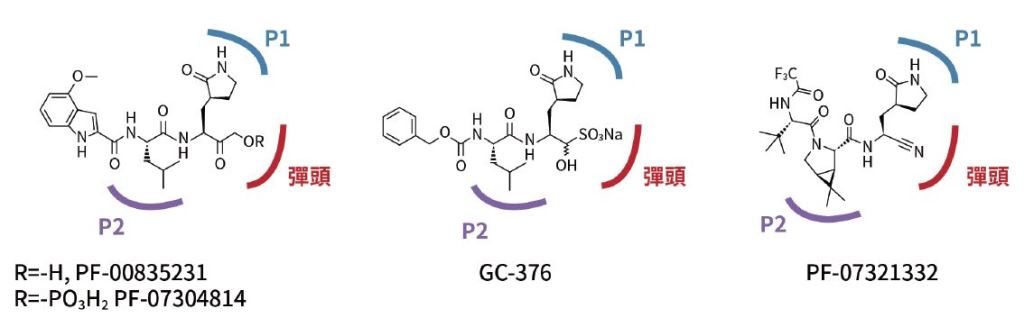
圖二:部分3CL 蛋白酶抑制劑的結構,其中PF-07321332 是輝瑞口服藥的主要活性成分;而GC-376 應用在治療貓冠狀病毒感染;PF-00835231 是2002 年香港爆發初代SARS 後,研發出的第一代3CL 蛋白酶抑制劑。
帕克洛維有效嗎?適用於哪些情況?
相較於疫苗,輝瑞的口服藥物、其公開數據、研究非常少見,僅能從該公司的新聞稿得知,帕克洛維臨床一期約在今年3月啟動、年中完成;2/3期在9月啟動,而在11月5日發布新聞稿,宣布期中數據的結果極佳、提前暫停招募受試者。鑒於缺乏公開數據,本文僅就新聞稿等探究帕克洛維的優、劣勢。
帕克洛維口服的方式相當簡易,每隔12小時服藥一次,連續5天即可。據新聞稿所述,在症狀發作的5天內吃藥,到了第28天,安慰劑組約6.7%惡化成重症或死亡(612名受試者,41人重症,其中10人因病亡故),而藥物組僅1%惡化成重症、且無人死亡(607名受試者,6人重症,0人因病亡故)。重症或死亡比率從6.7%降至1%,換算的療效約85%。若能在症狀出現的3天內吃藥,則療效更能提高到89%。
輝瑞設計此帕克洛維的主要目的是「阻止高風險族群重症/死亡」,因此受試者「必須都符合」下述條件:
✔COVID-19確診
✔病情為輕症
✔進行試驗前5天內,曾經出現過COVID-19症狀
✔高齡者,或至少罹患一項「可能惡化成重症」的慢性病,如:肥胖、糖尿病、心臟病等
與默沙東的莫納皮拉韋比較
兩者的差異
輝瑞新聞稿敘述帕克洛維可降低重症風險將近九成;而默沙東的新聞稿,表示自家藥物可降低重症風險約五成。但這不代表輝瑞藥物遠勝默沙東,兩種藥物的公開研究都太少,無法判斷兩者之間的優劣。
承上,同理可知,兩種藥物的副作用也尚未明瞭。儘管兩家藥廠都宣稱副作用和安慰劑相似,但目前的試驗人數,輝瑞僅收了1219人、默沙東僅收了775人,僅有千餘人的安全數據,很難看出藥物更少見的副作用。
而輝瑞的帕克洛維同時包含了PF-07321332和利托那韋(ritonavir)兩種藥物, 患者除了要承受PF-07321332的副作用外,也要考慮到利托那韋帶來的影響,如:利托那韋的功能為抑制人體代謝藥物,若患者同時也服用某些藥物(如:抗癌藥物),則可能會產生交互作用、導致體內藥物濃度過高。
而機制的部分,儘管兩款藥物都針對感染早期(出現症狀後的5天內),但各自針對不同的酵素。輝瑞的帕克洛維針對3CL蛋白酶,讓病毒無法產出生存必須的蛋白質;而默沙東的莫納皮拉韋則針對RNA依賴性RNA聚合酶,讓病毒複製產生致命性突變。
因此,理論上確實有可能以這兩種藥物同時採用進行「雞尾酒式療法」──兩種不同機制的藥物綜合使用,以提高療效、降低抗藥性病毒的機率。但現實上,有一定的難度,因為它們有著共同的劣勢。
(Photo by Julia Zyablova on Unsplash)
兩者共同的劣勢
帕克洛維與莫納皮拉韋最大的共同問題,是「錢」。就美國政府採購價而言,默沙東的莫納皮拉韋,單價每人712美元,合台幣超過2萬元。輝瑞的帕克洛維,單價為每人530美元,合台幣約1.5萬元。動輒上萬元的藥物,很難推動自費,也會對政府財政造成壓力。
此外,口服藥還需要面對的隱憂,包括了人類的惰性,人類始終是懶惰的。口服藥的優點是「在家自己吃」、缺點是「在家就會隨便吃」。隨意亂吃非但可能治不好病,還可能會養出具備抗藥性的病毒。這也是在醫療使用上值得審慎考慮的部分。
在這場世紀大瘟疫裡,科學已經打贏病毒,人類唯一無法戰勝的事情,是人性。
保持冷靜,繼續前進。Keep Calm and Carry On.
參考文獻
1. Philip V’kovski et al., Coronavirus biology and replication: implications for SARS-CoV-2 Nature Reviews Microbiology, 2021.
2. Sven Ullrich & Christoph Nitsche, The SARS-CoV-2 main protease as drug target,Bioorganic & Medicinal Chemistry Letters,2020.
3. Dafydd R Owen et al., An oral SARS-CoV-2 Mpro inhibitor clinical candidate for the treatment of COVID-19, Science, 2021.