- 科技報導
文章專區
2021-11-16首款COVID-19口服用藥出現?來自科學的雷神之錘-莫納皮拉韋
479 期
Author 作者
蔣維倫/泛科學PanSci專欄作家、故事專欄作家、udn鳴人堂專欄作家、前國衛院衛生福利政策研究學者。喜歡虎斑、橘子、白底虎斑和三花貓。
「莫納皮拉韋」(molnupiravir)是一款名稱來自雷神之錘(Mjölnir) 的藥物,能降低2019冠狀病毒疾病(COVID-19)五成的重症或死亡風 險,可望成為第一款對抗疫情的口服用藥。
在今(2021)年10月前,治療COVID-19的藥物,幾乎都是靜脈給藥的劑型,如瑞德西韋(remdesivir)、單株抗體等,治療上並不便利。而到了10月初,美國默沙東藥廠(Merck Sharp & Dohme, MSD)發布新聞稿,說明其開發的口服用藥——莫納皮拉韋三期試驗的中期數據成功,而臺灣政府也表達採購意願。莫納皮拉韋是什麼藥?真的有這麼神奇嗎?
一天吃2次,新冠病毒遠離我?
由於COVID-19不可能消失,未來一定還會陸續有人感染,甚至爆發小規模的流行。倘若治療手段僅有靜脈注射,將對患者和醫護造成沉重負擔。若輕症患者要接受治療,也得住院多日,並由醫護注射治療,不僅對患者來說相當不便,也十分損耗醫療人力。因此開發一款能讓病人「自行口服」的藥物,將有助於緩解醫療量能、提高病人服從度。
莫納皮拉韋的臨床二a期試驗結果
默沙東在疫情初期,也就是去(2020)年6月即啟動莫納皮拉韋的臨床二a期試驗,想了解藥物能否降低上呼吸道(鼻咽)中新型冠狀病毒(SARS-CoV-2)的病毒量,以評估藥物降低傳播力、減輕病症的潛力。
該次試驗招募了約200名COVID-19確診,且在7天內出現症狀的受試者。這些受試者被分成4組,分別為「服用藥物200毫克」、「服用藥物400毫克」、「服用藥物800毫克」、「服用安慰劑」,每12小時服藥一次,療程共持續5天。
其中,測試藥物成效的方法有兩種,分別是:
• 鼻咽檢體內,已無法培養出可感染Vero E6(亦稱Vero C1008)〔註〕細胞的病毒
• RT-PCR檢驗轉陰
如表一所示,試驗結果相當正面。在療程第3天,服用安慰劑組仍有16.7%的患者,上呼吸道有具傳染力的活病毒,而服用藥物800毫克組已僅剩1.9%的患者可培養出活病毒。而到了療程結束的第5天,藥物表現更佳:所有服用藥物400和800毫克的受試者,其鼻咽處皆已無具感染力的活病毒;安慰劑組則仍有約11%患者,具有COVID-19傳染力。且試驗中並未出現嚴重的不良反應,足以支持研究團隊繼續進行三期臨床試驗。
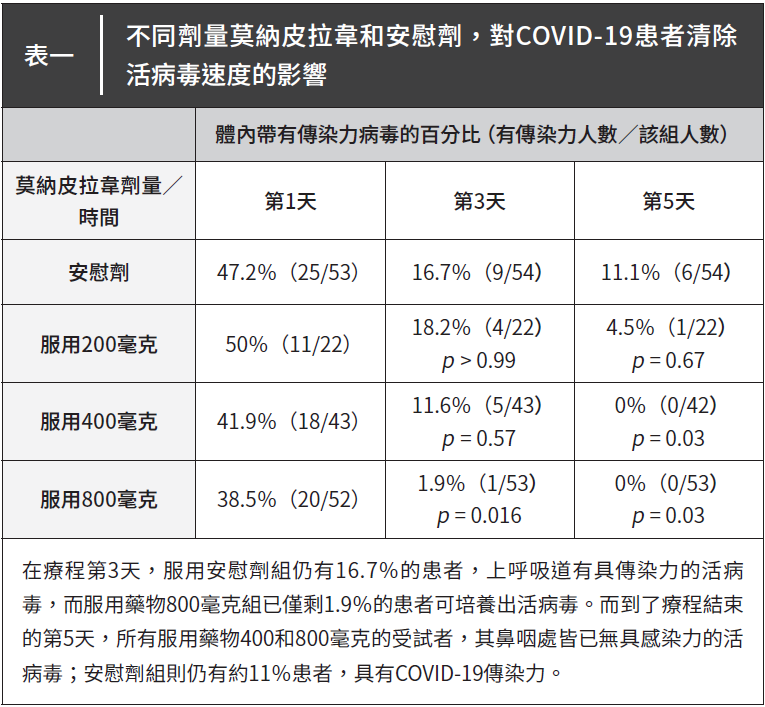
此試驗結果帶給科學家信心,證明莫納皮拉韋可加快清除受感染患者上呼吸道的活病毒,降低患者的傳染力、縮短隔離時間、減輕疫情對經濟的衝擊。而口服劑型的優勢,除了可讓患者居家自行服用外,更提高了他們遵守醫囑的意願,也舒緩了醫療院所的負擔。
臨床試驗二a期證明了莫納皮拉韋可協助病人清除病毒、降低傳染力,而接下來的三期試驗將是重頭戲,藥物能否進一步證明自己能避免重症、阻止死亡呢?
莫納皮拉韋的臨床三期試驗結果
莫納皮拉韋的三期試驗在今年夏天展開,重點在於驗證藥物預防疾病惡化重症、阻止死亡的能力。藥廠原先預計招募1550名患者,然而在分析了775人的期中數據後,卻因為藥效太好而和美國食品藥物管理局(U.S. Food and Drug Administration, FDA)商討決議暫停招募新受試者,立刻向政府申請緊急使用許可(Emergency Use Authorization, EUA)。那麼,實驗內容是什麼?藥效究竟有多棒呢?
首先,我們可以從受試者條件,觀察口服藥物莫納皮拉韋的目標。試驗聲明受試者的條件必須都符合下述條件:
✔COVID-19確診
✔病情在輕∼中度
✔在試驗前5天內出現COVID-19症狀
✔高齡(年齡大於60歲),或必須至少罹患一項「可能惡化成重症」的慢性病,如:肥胖、糖尿病、心臟病等
可以發現藥廠希望該藥物能阻止「疾病惡化成重症,甚至死亡」的過程,並非試圖拯救已經發展成重症、瀕臨死亡,或是年輕力壯、不易患重症的患者。本次研究將受試者分成4組,分別為「服用藥物200毫克」、「服用藥物400毫克」、「服用藥物800毫克」和「服用安慰劑」,每12小時服藥一次,療程共5天。整個研究過程將觀察受試者從服藥後∼第29天期間,各組重症住院或死亡的比例以判定療效。此為多國試驗,臺灣亦為參與國之一。
據新聞稿所述,期中分析數據相當正面:莫納皮拉韋降低約50%的重症或死亡風險,且療效不受變異株的影響。科學家發現,在試驗的第29天,安慰劑組約14.1%惡化成重症或死亡(377名受試者,53人重症或死亡,其中8人因病亡故),而藥物組僅7.3%惡化成重症,且無人死亡(385名受試者,28人重症)!在藥物的幫助之下,重症或死亡比例從14.1%降至7.3%,降幅約五成;簡言之,藥物減少了約50%的重症或死亡風險。而將四成受試者體內的病毒基因定序後發現,莫納皮拉韋的效果對Gamma、Delta、Mu變異株都相似,意即莫納皮拉韋對現行的變異株具有相同的療效。
而在不良反應上,藥物組和安慰劑組的發生率接近,分別為35%和40%,展現出它的安全性。各種正向的數據振奮了藥廠,且特別令人欣喜的是,三期試驗的受試者為高齡,或有慢性病的脆弱族群,莫納皮拉韋挑選了最脆弱的人、直球對決,並且勝利。不過莫納皮拉韋為什麼能消滅SARS-CoV-2呢?
莫納皮拉韋的藥理機制
要消滅冠狀病毒,就要先了解它的生活史。冠狀病毒屬單股正鏈RNA病毒(+ssRNA viruses, positivesense single-stranded RNA virus),病毒顆粒內包裹著一條單股正鏈RNA;因為該RNA承載著病毒全基因組,故也稱為+gRNA(positivestrand genomic RNA)。
如圖一所示,當病毒經歷重重阻礙進入細胞後,會釋出+gRNA,其後被RNA複製酶(RNA-dependent RNA polymerase, RdRp)作為模版,複製成兩款「反鏈RNA」,分別是–gRNA(negative-strand genomic RNA)和–sgRNA(negative-strand subgenomic RNA)。而–gRNA可再對應複製出成千上萬+gRNA,做為病毒基因組,包裹在子代病毒裡;–sgRNA則可對應複製出+sgRNA,再轉錄成病毒結構蛋白,做為子代病毒的零組件。
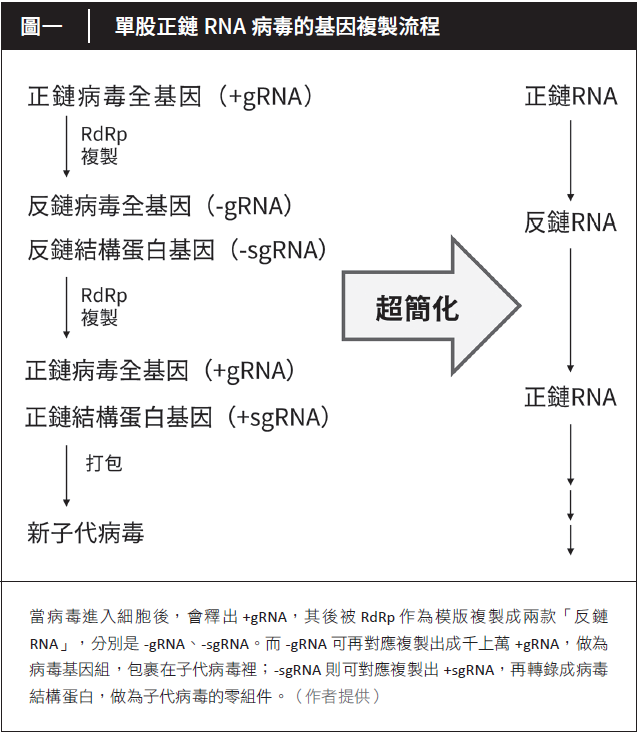
聽起來有點複雜嗎?圖一右側即是簡化版:在單股正鏈RNA病毒的繁殖過程裡,RdRp會以前一個步驟的RNA做為模版,持續地複製下去。因此若我們能干擾RNA複製,不論是強制中止或強迫出錯,就可使病毒無法培育子代,進而消滅病毒、治療疾病。
科學家通常會使用「假的」核苷酸去強行中止RNA複製。例如雷巴威林(ribavirin)等結構類似核苷酸的化合物,能偽裝成正常核苷酸,嵌入RNA鏈中,強行停止RNA複製。然而此類直接強行中止複製的藥物,通常對冠狀病毒無效,因為該病毒家族具備除錯用的酵素,當複製意外中止時,這類酵素便會移除RNA鏈最後的那個可疑核苷酸,再安裝新的核苷酸上去,故此類藥物對冠狀病毒無效。
而之前首個被許可對抗SARSCoV-2的瑞德西韋,也是「假的」核苷酸。但它並非直接、立刻中止複製,而是在RNA鏈嵌入瑞德西韋,再添加3個正常的核苷酸後,才會卡住酵素、停止病毒的RNA複製。因此即使移除最後一個核苷酸,也無法排除瑞德西韋,恢復原先的複製動作。
莫納皮拉韋雖然也是「假的」核苷酸,但卻採取了完全不同的策略——它不中止RNA複製,而是誘使RdRp看錯,做出一堆無效、錯誤百出的RNA,導致冠狀病毒永遠生不出有用的小孩!
越複製、錯誤越多
莫納皮拉韋是一種誘變劑,試圖讓病毒以超乎常理的速度發生錯誤突變,例如引爆大量致死性、災難性的突變發生,最終無法產出有效後代。
正常的情況下,組成RNA的4種鹼基—— 鳥嘌呤(G) 、胞嘧啶(C)、腺嘌呤(A)、尿嘧啶(U)——會兩兩配對:G配對C,U配對A。在沒有干擾時,RdRp會類似影印機,用正鏈RNA印出反鏈RNA、然後再列印出正鏈RNA,此過程經過無數次重複後,就能生出無止盡的病毒後代。而在過程中,上述4種鹼基會兩兩配對,確保每一代的基因都能完美複製,以避免病毒生存必須的基因受到致命突變的破壞。
但當人類吃了莫納皮拉韋後,就不一樣了。
因為分子結構相近,莫納皮拉韋在RdRp眼裡,長的非常像C、U(圖二),這種模稜兩可、差不多先生的特性,使得RdRp在每次複製時都會出現錯誤,且這個錯誤還會累積到下一次。一但病毒複製越多次、錯誤越多,災難性的突變將爆炸式成長,最終惡化成病毒的致死突變。
接下來以圖三進一步說明。我們可以先將病毒基因簡化為只有12個鹼基,RNA序列依序為GGGCCCAAAUUU。並且此病毒只生產一代,換言之,RNA複製的過程會發生兩次(正鏈RNA→反鏈RNA→ 正鏈RNA)。來看看莫納皮拉韋存在時,會發生什麼事。
當莫納皮拉韋進入細胞後,會被RdRp視為C或U鹼基,意即理論上應出現C或U的地方,將可能被莫納皮拉韋取代。從圖三可看出,第一次複製後的–gRNA,裡面有多個鹼基是莫納皮拉韋;而後有問題的–gRNA,再被RdRp做為模版,準備製作子代病毒的+gRNA。
由圖三的第二次複製裡可看出,莫納皮拉韋依舊被當成C或U,因此新合成的RNA鏈與對應的新鹼基,可能是G,也可能是A!原先理應代代相傳的基因,卻因藥物介入而不再嚴謹遵守本來的複製規則。從圖三下圖可看出,即便只有12個鹼基並生產一代,就可能出現3處鹼基的突變,且第二代的+gRNA裡也含有莫納皮拉韋,能夠在接續的子代裡,持續誘發更多突變。
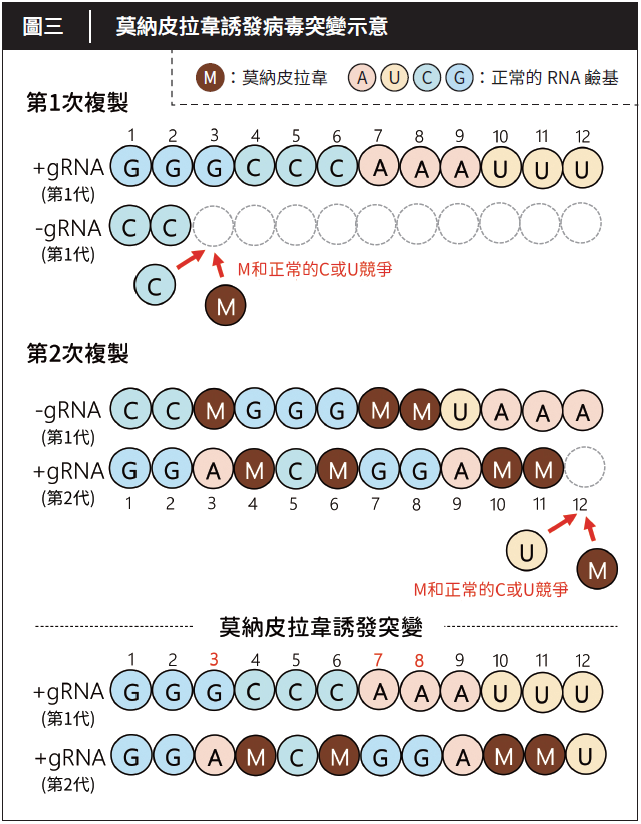
原始鹼基兩兩配對的嚴格機制,因為莫納皮拉韋模稜兩可的特性, 造成突變。原本正確的配對是G→C→G、A→U→A、U→A→U等;但在加入藥物後,卻會出現G→M→A、A→M→G、U→A→M→G等各式各樣的突變,且突變會累積在每次的複製產物裡,越複製、錯誤越多,最終導致病毒死亡。
莫納皮拉韋的優勢
莫納皮拉韋的目標是病毒的RdRp,而此酵素在冠狀病毒家族裡,具有高度的序列保守性,如SARS-CoV-2和2002年在香港爆發的SARS-CoV,兩者的RdRp基因有99.1%相似性,胺基酸則有96%的相似性 。換句話說,即使未來有更可怕的新冠狀病毒爆發,由於RdRp在該家族裡都長得很像,因此可以預期莫納皮拉韋也能發揮療效,阻止未來的新冠狀病毒疫情。
而莫納皮拉韋的另一優勢,是它對於變異株的療效。在世界各國普遍施打疫苗後,幾乎人人都有辨識病毒棘蛋白的抗體,而在「人擇」壓力下,能穿透疫苗防禦的變異株,將多數源自於棘蛋白的變異。但這些變異株,其核心的RdRp因為未受「疫苗人擇」的壓力,可預期仍和最原始的祖先相似,因此可合理推估,短期內莫納皮拉韋面對各種,甚至未來的病毒變異株也將有療效。
一藥平定天下?
有了COVID-19口服藥後,就不用打疫苗了嗎?
這樣的觀念大錯特錯。莫納皮拉韋的主要功用是「治療」,而疫苗是「預防」,彼此之間並無相互取代性。疫苗就像汽車的安全帶,而莫納皮拉韋則是像醫院裡的葉克膜(extra-corporeal membrane oxygenation, ECMO)就算醫院裡擺了好幾臺葉克膜,開車還是要繫安全帶,否則一出車禍就重傷,再多葉克膜也救不了。
此外,莫納皮拉韋還有著根本的劣勢:
價格
依外電報導,美國向默沙東採購的價格為「一次療程712美元」,換算下來約台幣2萬元。如此高的金額,不太可能「人人有藥吃」,也很難推動自費購買。
只對輕~中度病症有效
由於莫納皮拉韋只能抑制病毒複製,對於COVID-19重症,如因免疫系統故障引起的過度發炎、血栓等致命症狀患者,並無改善的療效。
故可推測此藥物對挽救COVID-19重症患者的生命,恐無效。
只在感染初期有效
因為莫納皮拉韋的藥理機制是干擾病毒複製,所以須在複製最高峰的階段投藥,才有療效。換言之,它和克流感一樣,須在剛有症狀的數天內服藥。若無法及時診斷COVID-19,或無症狀患者,在實際治療現場,還是很難有效的投藥。
潛在的副作用
儘管三期試驗未看到嚴重的副作用,但科學家已發現,在人類細胞粒線體中的RNA聚合酶(DNA dependent RNA polymerase)也會誤用莫納皮拉韋;同時也已發現該藥對哺乳類細胞有誘發突變的效果。因此莫納皮拉韋的副作用,將是未來必須持續追蹤研究的方向。
仍有相當風險會惡化成重症
從新聞稿中可得知,儘管莫納皮拉韋有療效,但在藥物組裡仍有約7%的受試者會惡化成重症。這顯示了藥物並非仙丹,仍無法遏止部分患者邁向更糟的病程。
總結而言,莫納皮拉韋做為第一款對抗COVID-19的口服藥物,有其歷史地位和重要性,有望減輕醫護壓力和紓緩經濟衝擊,但切勿因此而拒打疫苗,因小失大。
保持冷靜,繼續前進。
Keep Calm and Carry On.
〔註〕Vero E6細胞為非洲綠猴(Chlorocebus sabaeus) 腎臟細胞的衍生細胞株, 能用於嚴重急性呼吸道症候群冠狀病毒(SARS-CoV virus)、狂犬病毒(Rabies virus)、日本腦炎病毒(Japanese encephalitis virus)等分子與細胞生物學研究。
延伸閱讀
2. William Fischer, Joseph J. Eron Jr, et. al. (2021) Molnupiravir, an Oral Antiviral Treatment for COVID-19. MedRxiv. DOI: https://doi.org/10.1101/2021.06.17.21258639
4. Florian Kabinger, Carina Stiller. et. al. (2021) Mechanism of molnupiravir-induced SARS-CoV-2 mutagenesis. Nature Structural & Molecular Biology. DOI: https://doi.org/10.1038/s41594-021-00651-0
7. Calvin J. Gordon, Egor P. Tchesnokov, Raymond F. Schinazi, Matthias Götte (2021) Molnupiravir promotes SARS-CoV-2 mutagenesis via the RNA template. Journal of Biological Chemistry. https://doi.org/10.1016/j.jbc.2021.100770