- 專欄
文章專區
2021-11-02打了高端疫苗後,身體裡會產生哪些免疫反應?
623 期
Author 作者
蔣維倫/泛科學PanSci專欄作家、故事專欄作家、udn鳴人堂專欄作家、前國衛院衛生福利政策研究學者。喜歡虎斑、橘子、白底虎斑和三花貓。
在2019冠狀病毒疾病(COVID-19)的威脅下,世界各國都傾力研發本國疫苗,臺灣也不例外。而在國產疫苗的賽道上,初期有國光、聯亞、高端3家競逐,國光於一期試驗後落馬,今(2021)年初,另兩家疫苗先後進入二期試驗。衛生福利部食品藥物管理署(以下簡稱食藥署)於今年6月10日,公布國產COVID-19疫苗的緊急使用授權(EUA)審查標準(圖一),其內容和歐美不同,歐美通常以三期試驗的保護力為門檻,但臺灣卻以疫苗誘導的「中和抗體」(neutralized antibody)〔註〕為審查標準(圖二)。
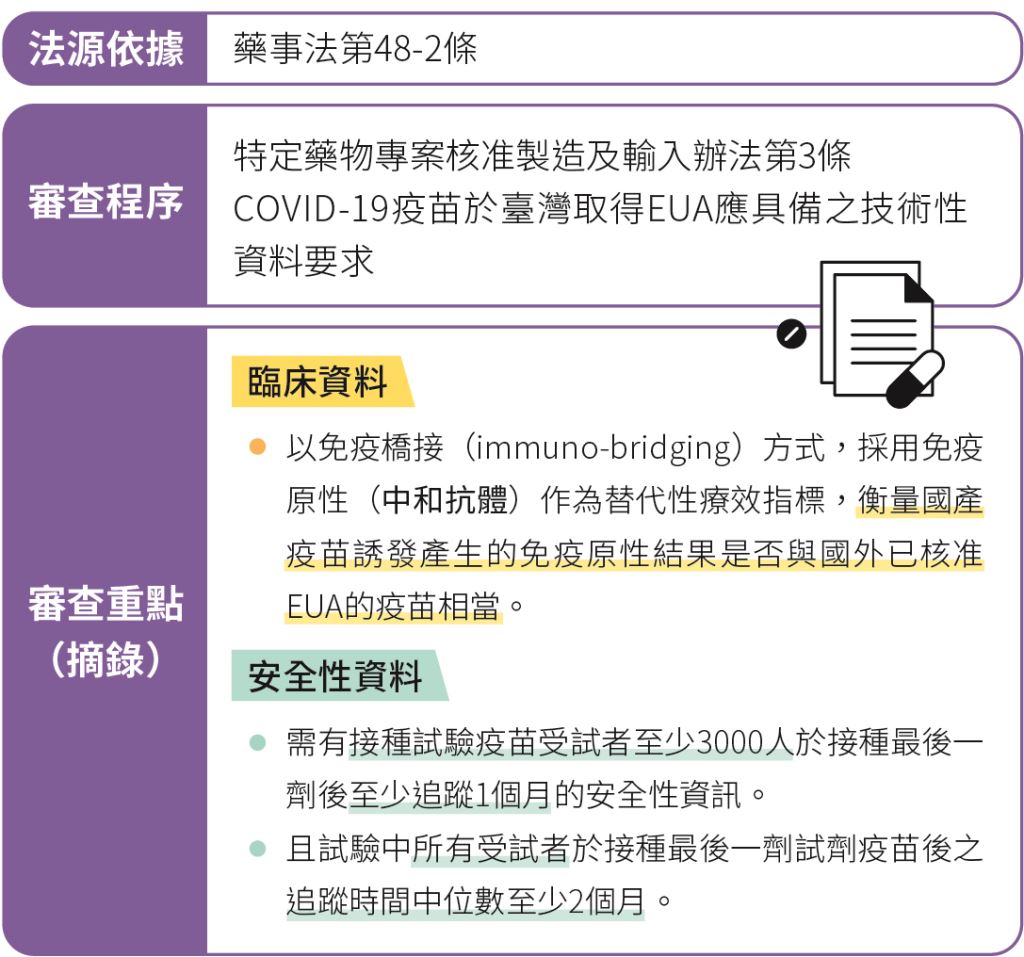
圖一:我國COVID-19疫苗的EUA審查標準
圖二:我國COVID-19疫苗療效評估標準
〔註〕當人體受到病毒感染,或是施打疫苗的時候,免疫系統就會產生抗體抓住那些外來物。若這些被製造出的抗體能抓對位置,便能成功「中和」病毒的毒性,防止病毒、異物進入細胞,因此又被稱為中和抗體。
今年7月19日,食藥署宣布高端COVID-19疫苗通過EUA審查,成為全球首支以中和抗體效價為準、通過國家審查的COVID-19疫苗。本文透過高端疫苗一、二期的公開論文(見延伸閱讀3)和新聞稿,簡要地介紹它的優勢和挑戰。
高端疫苗,裡頭裝什麼?
有別於mRNA疫苗如莫德納(Moderna)、輝瑞/BNT疫苗(Pfizer/BNT),以及採用腺病毒(adenovirus)載體的AZ疫苗(AstraZeneca vaccine),高端選用了傳統的蛋白質技術,該技術的關鍵在於「抗原」和「佐劑」。好的抗原能誘發正確的抗體,而優秀的佐劑則可以安全地提高抗體濃度,活化正確的T細胞,避免副作用。
好的抗原怎麼挑?很久以前,人類就盯上了冠狀病毒
歷經2002年的SARS與2012年的MERS兩波新興冠狀病毒的震撼後,科學家開始對冠狀病毒展開長期基礎研究,而在疫苗研究方面「如果有個全新的冠狀病毒,要怎麼做疫苗?」就成了科學家最關注的問題之一。
美國在2016年發現,若想對冠狀病毒家族開發疫苗,最佳的抗原將是融合前的病毒棘蛋白(prefusion conformation of spike protein)。它不僅能誘發高濃度的抗體,還會結合人體細胞受器,進而撬開細胞膜、感染細胞。也就是說,「棘蛋白」就是病毒侵犯細胞的鑰匙,只要疫苗能激發出針對棘蛋白的中和抗體、堵住病毒的鑰匙,就能中斷感染。此外,科學家也發現棘蛋白會自然形變、分解,因此建議微調胺基酸、固定棘蛋白結構,以達到有效誘發抗體的目的。
數年後,新型冠狀病毒(SARS-CoV-2)襲來,莫德納、諾瓦瓦克斯(Novavax)、高端疫苗等藥廠迅速啟動、遵循建議,選用棘蛋白為抗原,並微調胺基酸、固定結構。通常將原先位於病毒棘蛋白序列上第986、987位置上的離胺酸(lysine, K)與纈胺酸(valine, V)都改成脯胺酸(proline, P),故調整後的棘蛋白,簡稱為S-2P。以高端疫苗而言,它和美國國家過敏和傳染病研究所(National Institute of Allergy and Infectious Diseases, NIAID)合作,由美國提供已鑲入S-2P基因的DNA質體,再由高端轉殖入倉鼠卵巢細胞(ExpiCHO-S),讓細胞大量分泌棘蛋白以做為疫苗(圖三)。
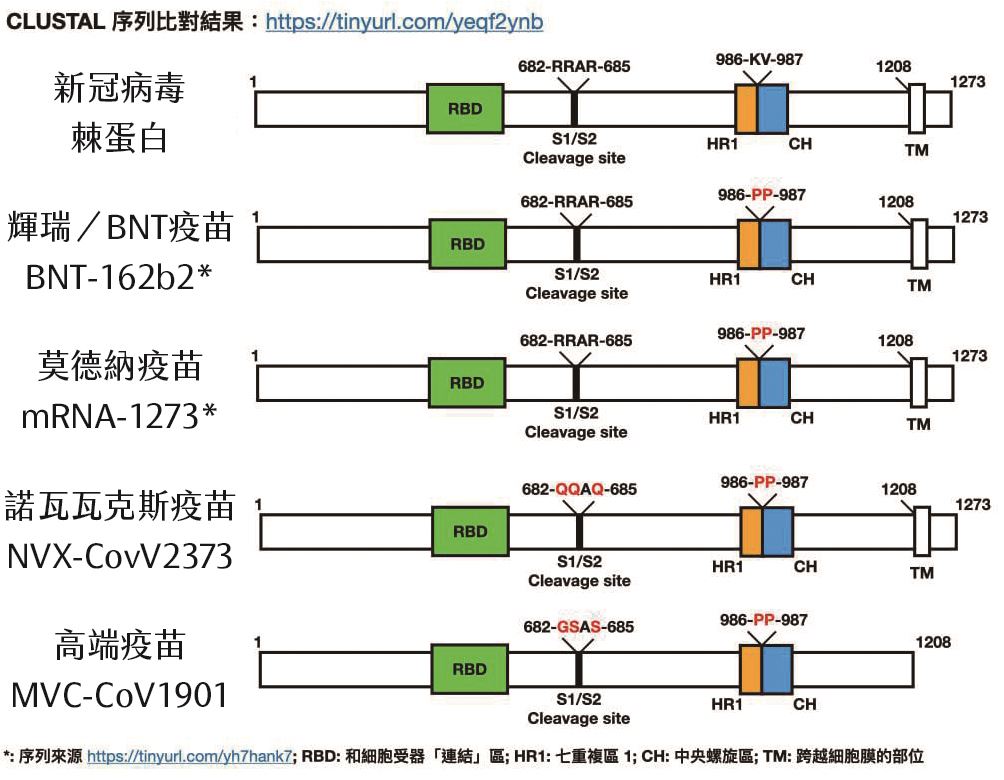
圖三:各家疫苗的抗原胺基酸序列比較。(Tsai-Yi Lu提供)
打了那針後,身體發生什麼事?
當高端疫苗注入肌肉後,棘蛋白會被抗原呈現細胞(antigen-presenting cell, APC),例如樹突細胞、巨噬細胞等,或B細胞(B cell)吞噬。
而抗原呈現細胞的職責是活化T細胞。它吞噬外敵後,會將敵方撕成碎片、再透過一種稱為「主要組織相容性複合物」(major histocompatibility complex, MHC)的特殊膜蛋白,展示給兩類T細胞——輔助T細胞(helper T cell,CD4+ T 細胞)與殺手T細胞(killer T cell,CD8+ T 細胞)。
• 輔助T細胞,由MHC Ⅱ接收抗原:
輔助T細胞的角色近似於總司令,會針對免疫細胞下達整體的作戰指示。除了能刺激B細胞分泌更多抗體、活化巨噬細胞、殺手T 細胞等,還能分化為CD4+ 記憶T細胞(CD4+ memory T cell),長期保護人體。
• 殺手T細胞,由MHC Ⅰ接收抗原:
殺手T細胞負責殺死被病毒感染的殭屍細胞、清掃戰場,避免更多病毒產生,可能是遏止疾病被誘發為重症的關鍵之一。能分化為CD8+ 記憶T 細胞(CD8+ memory T cell),長期保護人體。
抗原能直接和B細胞受體(B-cell receptor)交互作用。對B細胞而言,其細胞表面的抗原決定位(antigenic epitope)是抗原刺激、誘發相對應抗體分泌的位置,因此抗原的立體樣態是一大關鍵。若想誘導出中和抗體,疫苗抗原應盡可能地保持原始的立體結構。而高端、莫德納、諾瓦瓦克斯等3家疫苗廠商,都採用完整的棘蛋白,具備誘導高濃度中和抗體的潛力。而B細胞在輔助T細胞的刺激之下,也能分化成長壽的記憶型B細胞(memory B cell),長年保護人體(圖四)。
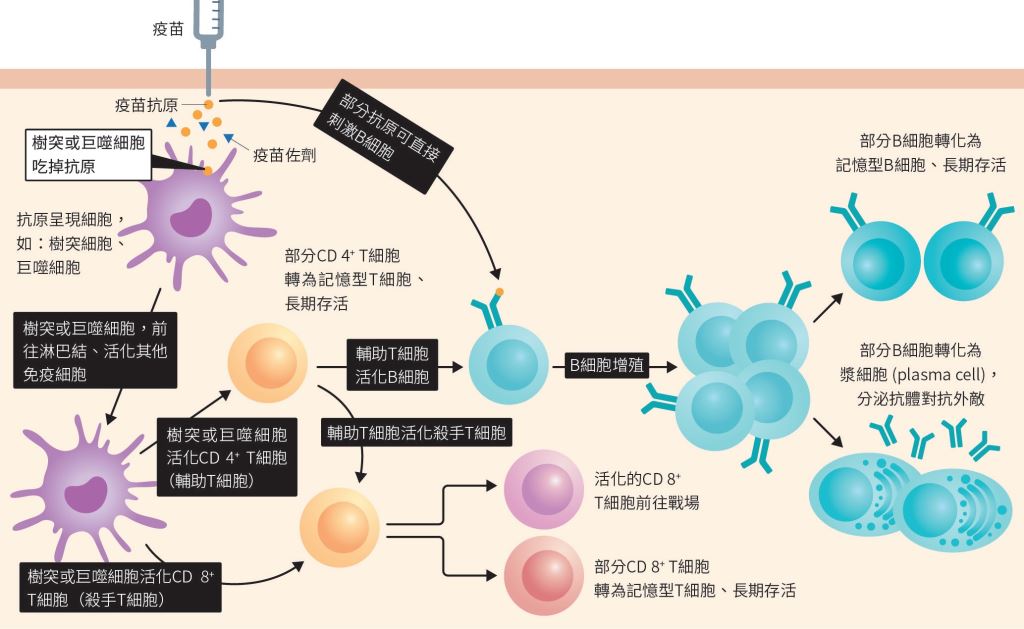
圖四:蛋白質類型疫苗,透過抗原呈現細胞活化B、T 細胞的簡易示意
佐劑是什麼?蛋白質疫苗中的詐欺獵人
高端疫苗混用了兩種常見的商用佐劑,分別為鋁鹽和CpG1080。佐劑的目的有兩個:
1. 仿造病原體入侵、組織發炎的訊號,誘使更多的抗原呈現細胞抵達現場。
2. 促使抗原呈現細胞活化正確的T細胞路徑。由於輔助T細胞被活化的路徑,還能再被細分成TH1、TH2、Tfhs等路徑,若輔助T細胞的活化偏向TH2 路徑,將可能引起肺臟過度發炎,導致重症、致命的副作用。因此佐劑需觸發理想的T細胞路徑,以避免嚴重副作用。
而高端疫苗裡的鋁鹽能損傷部分組織,偽造人體被微生物破壞的信號;CpG1800 則是具有細菌DNA 的特徵,能欺騙細胞,使細胞誤以為是細菌入侵。
高端疫苗的設計,有沒有達到目的?
使用mRNA、腺病毒等疫苗技術,都會綁架細胞來分泌抗原,彷彿真實病毒感染,因此身體的不適感較重;而蛋白質疫苗則無須劫持細胞,所以安全性和副作用是高端疫苗的最佳優勢。觀察高端疫苗二期試驗的不良反應數據(圖五),可看出高端疫苗的不良反應和安慰劑組相近。顯示高端疫苗的不適感,和食鹽水差不多,發揮了蛋白質疫苗的絕對優勢。
圖五:高端疫苗和安慰劑組,第1和第2劑的不良反應比例
而相較於輝瑞/ BNT、AZ 疫苗等歐美疫苗,高端疫苗的頭痛、發燒等症狀更少(圖六),展現了可望和歐美疫苗比肩,甚至更優秀的潛力。
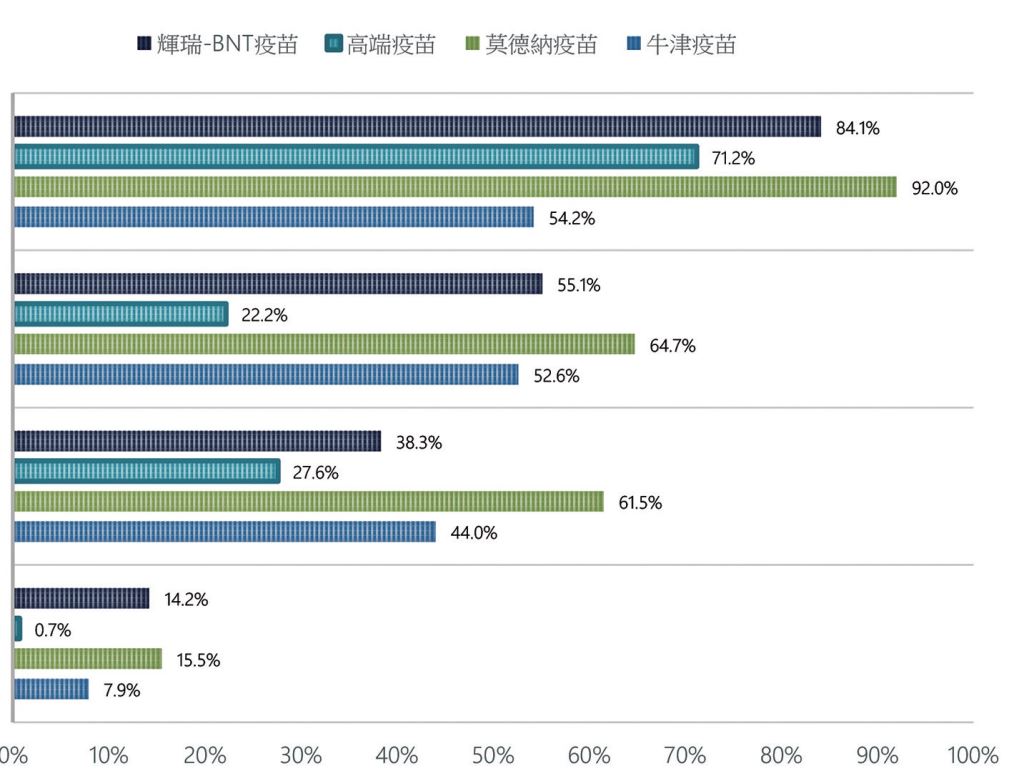
圖六:高端疫苗和其他疫苗的副作用頻率比較。(資料來源:疾病管制署)
高端疫苗的抗體產生能力如何?
在高端疫苗二期試驗報告中,20~64歲受試者的血清轉換率(seroconvertion rate)〔註〕約為99.9%; 而65歲以上的受試者,也有高達99.5%能產生抗體,從上述數據可看出,打了高端疫苗後,幾乎所有人都能產生抗而中和抗體效價(Wild Type SARSCoV-2 Neut ralizing Antibody Geometric Mean Titres)數據顯示,20~64歲受試者可達732.9(95% CI[692.4, 775.7]);65歲以上族群較低,約為484.55(95% CI [433.2, 542])。但因為缺乏和其他疫苗的比較數據,因此無法得知其優劣。就二期試驗的數據而言,我們可以知道:
1. 幾乎所有人接種疫苗後,都能產生抗體。
2. 年長者抗體效價較低,若有第三劑的規畫,年長者應優先施打。
3. 抗體數據足以支持進行三期試驗,研究抗重症、抗死亡的能力。
高端疫苗,真的可以用嗎?
在理想情況中,新興疾病的疫苗應進行三期試驗。但由於全球疫苗供貨困難,若僅仰賴進口,恐怕會使得臺灣疫情有失控危機,因此食藥署只得屈就於現實,對國產COVID-19 疫苗進行假設:
•3000 人的安全性數據,足以代表疫苗安全。
•中和抗體效價,可代表COVID-19 疫苗的保護力。
•AZ 疫苗的保護力,多數來自於中和抗體。
因此食藥署的審查標準中,包含3000人的安全性數據,以及中和抗體平均效價的95%信心區間下限,不可低於AZ疫苗的0.67倍。而高端疫苗的二期試驗結果合乎上述兩項審查標準——無重大安全疑慮,且中和抗體效價95%信心區間的下限,為AZ疫苗的3.4倍。因此高端疫苗成為國內,也是全球第一個透過抗體效價,取得許可的COVID-19疫苗。
但我們必須知道,缺乏三期臨床試驗,也就無法得知高端疫苗的「抗重症」、「抗死亡」能力,此點相當令人擔憂,我們仍希望高端疫苗未來能在疫區,用數據證明自己的保護力。在國產疫苗已惡化為臺灣執政黨與在野黨惡鬥的今日,令人聯想起多年以前,美國挑戰者號太空梭爆炸的報告裡,美國理論物理學家費曼(Richard Feynman)所說的:「成功的科技,需要依據事實而非公關,畢竟,大自然是無法愚弄的。」共勉之。
延伸閱讀
1. Tsun-Yung Kuo
et al., Development of CpG-adjuvanted stable prefusion SARS-CoV-2 spike antigen as a subunit vaccine against COVID-19,
Scientific Reports,Vol. 10: 20085, 2020.
2. Jiskoot W.
et al., Vaccines. In: Crommelin D., Sindelar R., Meibohm B. (eds) Pharmaceutical Biotechnology. Springer, Cham, 2019.
3. Szu-Min Hsieh
et al., Safety and immunogenicity of CpG 1018 and aluminium hydroxide-adjuvanted SARS-CoV-2 S-2P protein vaccine MVC-COV1901: interim results of a large-scale, double-blind, randomised, placebo-controlled phase 2 trial in Taiwan,
Lancet Respiratory Medicine, 2021.