- 科技報導
文章專區
2020-06-12人之所以異於禽獸者幾希? 新冠病毒疾病疫苗一定有解
462 期
Author 作者
張家榮/瑞寶基因研發處、國際事業處副處長
2019新冠病毒疾病(COVID-19)的快速散播及流行,影響了世界各地的人們。它迫使邊界關閉、城市封鎖、學校與各公開場所主動關閉,並損害全球經濟、考驗人性,甚至影響到原本地球村的運行模式。及時開發新冠肺炎疫苗是全球的當務之急,建立較高水平的社區(畜群)免疫力可降低病毒大流行傳播的能力,讓疫情控制在各國醫療能量所能承受的範圍內,才能讓世界恢復如常。
借鏡動物冠狀病毒疫苗的成功經驗
筆者從求學到業界,對COVID-19所屬的冠狀病毒並不陌生,尤其現在服務於動物疫苗公司,發現禽畜甚至到寵物,國內外都已有能對抗冠狀病毒的商業化疫苗可供使用。在獸醫畜牧界,冠狀病毒往往也對動物的健康及產業經濟造成嚴重損失,故使用疫苗來防控冠狀病毒,是常見且必要的手段。
以臺灣為例,使用在蛋雞上的鳥傳染性支氣管炎(Avian Infectious Bronchitis Virus, IBV)不活化疫苗(外商及臺廠)、使用在肉雞上的鳥傳染性支氣管炎減毒疫苗(外商及臺廠),以及貓傳染性腹膜炎(Feline Infectious Peritonitis Virus, FIPV)減毒疫苗(美商Zoetis)皆可合法販售使用。
 新冠病毒疾病大爆發,全球各地科學家也正如火如荼地研製疫苗,盼能趕緊讓疫情降溫。此為示意圖。(PIXNIO)
新冠病毒疾病大爆發,全球各地科學家也正如火如荼地研製疫苗,盼能趕緊讓疫情降溫。此為示意圖。(PIXNIO)
豬流行性下痢病毒(porcine epidemic diarrhea virus, PEDV)在2013年於歐美及亞洲發現新興流行株,造成全球養豬業嚴重損失,高致死率也導致豬價上揚。迄今,新興豬流行性下痢病毒在亞洲仍然猖獗,目前唯日韓大廠有製造此一疫苗,但亞洲市場評價不一,臺灣目前也尚無PEDV疫苗可用。筆者服務公司已與臺灣大學等研究單位合作開發新穎豬流行性下痢病毒不活化疫苗,目前已經過優良製造作業規範(Good Manufacturing Practice, GMP)試製完成,將向主管機關申請委託取代田間試驗,盼能早日取得藥品許可證,替臺灣畜牧產業解決問題。
從筆者自身以及產學界開發動物冠狀病毒疫苗的經驗來看,對產生中和抗體的任何疫苗提供結構正確的棘蛋白(spike protein)至關重要。棘蛋白顯示在病毒表面,與細胞受器(receptor)結合後,將進行重排並把病毒和細胞膜融合在一起,從而感染宿主細胞。因此,棘蛋白是一種動態且亞穩態的蛋白質,具有兩個主要結構狀態(即融合前和融合後)。
展示這種抗原,使其保持著原始天然預融合棘蛋白的表面輪廓和化學性質,將可保留引發高質量中和抗體反應所需的表位。但是,具有中和能力的免疫球蛋白G(immunoglobulin G, IgG)及免疫球蛋白A(IgA)免疫效期不長,因此,可透過疫苗佐劑(adjuvant)的精心設計補強不足,如誘導CD8+T細胞並驅動CD4+輔助型T細胞(T helper cells, Th)的免疫反應。佐劑不僅可用來提高基於蛋白質的疫苗誘導的抗體反應強度和持久性,還可以影響源自T細胞的細胞因子模式,從而調節免疫反應。
新冠疫苗開發,百家爭鳴亦或定於一尊?
疫苗的開發通常需要數十年的時間,因此,若想在今(2020)年底甚至明年前獲得可大規模分發的已批准疫苗,將是前所未有的一大挑戰。要達到此一目標需要疫苗生產平台、緊急應變或彈性法規,以及 國際醫藥品稽查協約組織(PIC/S GMP)的生物製劑量產能力這三個 關鍵互相配合。
新的生產平台,配合基於結構的抗原設計,計算生物學、蛋白質工程和基因合成可快速、精確地生產疫苗。目前,全世界正在競逐的新冠病毒疫苗可分為傳統疫苗(減毒或不活化病毒)、載體疫苗、核酸疫苗及蛋白質疫苗四類(表一)。傳統疫苗及蛋白質疫苗製造工藝相對成熟,較容易量產;載體疫苗和核酸疫苗最適合提高研發速度進入人體試驗,四類疫苗有各自的優點也有各自的瓶頸。
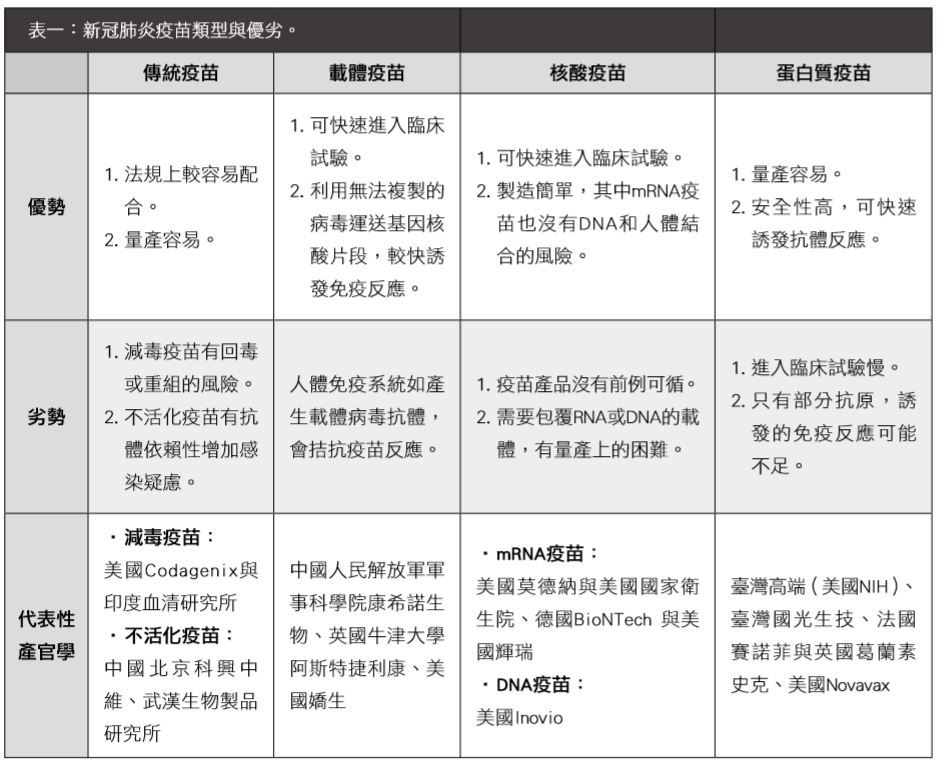 表一:新冠肺炎疫苗類型與優劣。
表一:新冠肺炎疫苗類型與優劣。
從下頁表一可看出,原本就有從事冠狀病毒研究的學研單位與生物製藥公司,利用學術單位的疫苗生產平台,並結合生物製藥公司符合法規的量產能力,是快速應變新興疾病的良好模式。此外,歐盟及美國等也都提出新冠肺炎緊急彈性法規,加快了表中所述的一些疫苗開發進度,在半年內從無到有,並已進入臨床試驗階段。如美國藥廠莫德納(Moderna)與美國國家衛生院(National Institutes of Health, NIH)的mRNA疫苗mRNA-1273已經進到臨床一期,美國藥廠輝瑞(Pfizer)與德國BioNTech合作的mRNA疫苗BNT162也在德國開始執行臨床試驗,而美國生技公司因諾維歐(Inovio)的DNA疫苗也完成試驗用新藥(investigational new drug, IND)的申請。
載體疫苗在中國跟英國牛津大學/阿斯特捷利康(AstraZeneca)的團隊,也都開始執行臨床一期;不活化疫苗的部份,中國北京科興中維開始執行臨床一期、武漢生物製品研究所已開始二期收案,但是依據相關公部門估計,可能還需要一年才可實現生產和疫苗的分發。其它針對COVID-19的90多種疫苗,全球公司和大學的研究團隊也正在嘗試不同的技術,其中一些技術從未在許可疫苗中使用過,也已開始在模式動物中進行測試。傳染性疫苗主要以預防為主,施打在健康的人身上,故其產業思維跟一般新藥有所不同,對於安全性的要求更勝於一般新藥。
此外,由於國安與公衛的考量,各國政府皆會介入疫苗的訂價,也使得疫苗價格並非完全由市場決定,且恐導致回收緩慢或效益不等比,這讓疫苗產業需投入的金額不亞於新藥開發。目前,全球疫苗市場主要由輝瑞、默克(Merck)、英國葛蘭素史克(GlaxoSmithKline, GSK)、法國賽諾菲(Sanofi)、美國嬌生(Johnson & Johnson)、阿斯特捷利康等大廠壟斷。在此前提下,可預見的是新冠肺炎疫苗前期會有不同生產平台在安全性跟效力互較長短,但隨著公部門、科學家與醫師對新冠病毒越來越瞭解,會聚焦在效力與安全性較先獲得驗證的兩、三個生產平台量產,新冠肺炎疫苗的藥證也很有可能落在上述全球大廠間。
Can Taiwan Help ?
臺灣在疫苗開發上的定位
臺灣在此次新冠肺炎大流行時,成功地守住疫情,甚至目前行有餘力,還可以用經驗跟防疫能量幫助其它國家。在新冠肺炎疫苗開發上,臺灣可以扮演的角色為何?筆者認為,因著臺灣特殊的國際地位,在新冠肺炎或其它新興傳染病疫苗的議題上,我們需從國安角度切入,「先自救、後救人」。疫苗廠是否要從無到有開發新冠肺炎疫苗或引入新技術開發,各家有各自的本益比評估;反而政府應補助或補貼國內具有上述四大類不同疫苗生產平台的PIC/S GMP生物製劑廠,以因應必要之時可徵召產線生產戰備需求疫苗使用。至於能力足夠的廠家,可以取得原廠授權代工,如此一來,若原廠無法供貨或供貨不足,也才有能量啟動緊急授權,不僅滿足疫苗自給率,也可供應他國。
臺灣因2003年對於SARS的防疫經驗及教訓,17年後在新冠肺炎疫調及防控上取得優異的表現。但鮮少人知道的是,因2003年爆發SARS之故,國科會(現科技部)及衛生署(現衛生福利部)皆有提撥經費專案補助中研院、國衛院以及一些大學等學術單位進行相關研究,可惜SARS雖來得兇猛卻去得也快,過往研究的成果戛然而止。所幸傳承得宜,當初的年輕研究人員及學生,半數在目前臺灣產官學界成為一方碩彥,才能在此次新冠疫情威脅下,試劑、疫苗與藥物國家隊一呼百應、緊急成軍。故建議政府單位應有固定預算進行人、畜新興傳染病病原基礎研究、演化及流行病學防控。
病毒不分國籍、人種或是政治傾向,相信這次新冠肺炎病毒不啻給世界一家一記重擊。《孫子兵法》〈九變篇〉有云:「故用兵之法,無恃其不來,恃吾有以待之;無恃其不攻,恃吾有所不可攻也。」如臺灣可在原有SARS及COVID-19的良好基礎上持續前進,做到料敵(病毒或病菌)機先而做下防範,相信我們不需要問「Who can help Taiwan?」,而可以自信的說「Taiwan can help WHO!」