- 科技報導
- 生醫先鋒
文章專區
2024-07-15呼吸道融合病毒不再無可抵禦 數十年的RSV疫苗研發之路
511 期
Author 作者
蔣維倫/泛科學PanSci專欄作家、故事專欄作家、udn鳴人堂專欄作家、前國衛院衛生福利政策研究學者。喜歡虎斑、橘子、白底虎斑和三花貓。
「80年啊……對人類來說是很長的時間了呢……」── 動漫《葬送的芙莉蓮》
1960年代的深冬,美國華盛頓特區的孤兒院裡,呼吸道融合病毒(respiratory syncytial virus, RSV)大舉入侵。在當年接種了尚在試驗階段RSV疫苗的嬰幼兒保護力結果出爐:此疫苗不僅沒有抗RSV病毒感染的效果,甚至還會加劇重症及死亡的機率——無施打疫苗組出現了約5%重症,相較之下施打疫苗組的嬰幼兒則有約80%染上重症。
1960年代的巨大失敗,標誌了後來RSV疫苗遲遲無法誕生的困境。
歷經數十年終於誕生的RSV疫苗
RSV、流感、特殊傳染性肺炎(COVID-19)是三種現階段對人類最具威脅性的呼吸道疾病病毒,目前後兩者已有疫苗,但唯獨RSV從1950年代末期被發現後,直至去(2023)年人類仍無法克服。RSV主要由飛沫沾染眼睛、口鼻傳播。它會與氣管上皮細胞結合,並將多個細胞融合成巨大的病灶。除此之外,RSV還有很多麻煩的特性。首先,人體對RSV缺乏終身免疫力,也就是說即使今年被感染過,同一個人明年冬季還是有可能會感染RSV。其次,RSV對嬰幼兒、銀髮族有嚴重的威脅,受感染的年長者約有10∼20%會惡化為重症、約2.5%死亡。而嬰幼兒因為呼吸道細小,被RSV殺死的細胞可能會堵住他們的氣管。
冬季容易使呼吸道傳染病蔓延,不僅可能直接導致更多人死亡,或是讓病床滿載、降低常規醫療(例如車禍、癌症、心血管手術)的量能;而父母必須請假照顧幼兒、親人,也間接地造成社會經濟損失。
面對RSV的難題,科學家經歷了數十年的研究。直到去年5月,荷蘭葛蘭素藥廠(GlaxoSmithKline plc, GSK)推出AREXVY®獲得美國食品藥物管理局(Food and Drug Administration, FDA)許可,史上第一款安全、有效的RSV疫苗終於誕生了(圖一)。
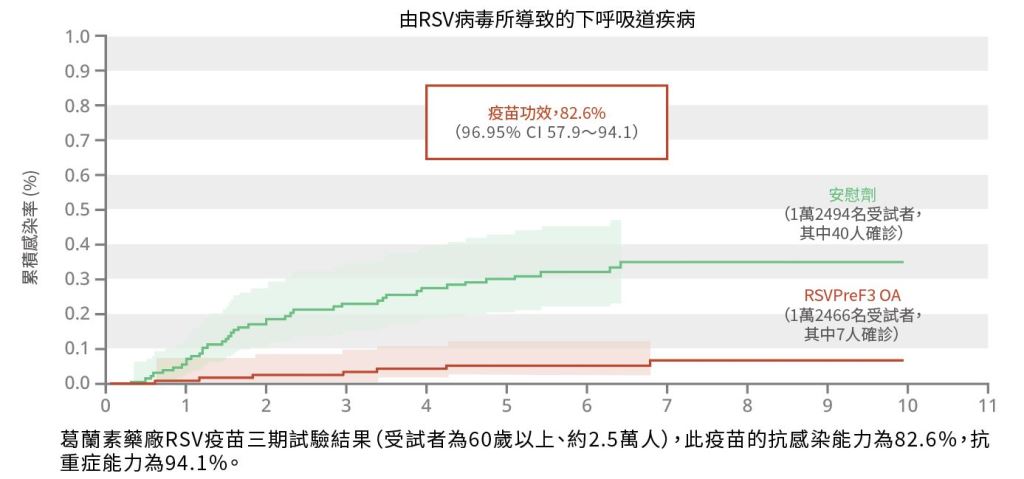
圖一| AREXVY® RSV 疫苗三期試驗結果(資料來源:Papi et al. 2023)
曾經慘敗的RSV疫苗如何取得成功
疫苗當然不可能在短時間內就研發成功。可以從一開始的慘敗到最終「破解詛咒」,必然有特殊的原因加上累積眾多研究而來的知識,RSV疫苗最終的成功即為經典案例。
在1960年代的RSV疫苗的臨床試驗中,科學界並未隱瞞疫苗造成受試者重病和死亡的事件,幾乎是反射動作地公開了資訊、發表在學術期刊。在相關的發表中,更直言表達了「矛盾、與想像中不同」的困惑,直面失敗並且公開分析。當年疫苗的設計是用甲醛(formaldehyde)也就是俗稱的「福馬林」處理RSV,再將經過處理的病毒作為疫苗、注射人體內。此疫苗的作用原理是為了提高人體血清針對RSV的中和抗體濃度,理論上可以藉此抵禦未來的RSV感染。由於當時尚未發展出其他的疫苗製備技術,就連蛋白質疫苗也還未研發成功,更別說DNA或mRNA疫苗。採用死病毒製備疫苗則是已有成功的先例,也就是多數人耳熟能詳的小兒麻痺「沙克疫苗」,因此這樣的疫苗製備思路在當年並沒有太大的問題。
而當時的初步測試也顯示,接種RSV死病毒疫苗後人體血清的RSV中和抗體提升了四倍以上。但最終的臨床結果卻出乎科學家意外,接種RSV疫苗的人在接觸病毒後,不僅無法預防感染,病症還有可能加重甚至是死亡。於是科學家們開始提出假設、探索證據、推測可能性,進而擴展視野。
深入探究免疫系統的運作
經歷了數十年的研究,累積觀察、知識、技術的提升,科學家逐步了解「以前不夠明白」的事物。首先,免疫系統的行為比原本構想的更複雜。而要討論RSV死病毒疫苗一開始的失敗,就必須提及免疫系統中T細胞(T cell)的作用。其中的輔助性T細胞(T helper cells, Th)遭遇到抗原時就會活化,最主要可分為第一型輔助T細胞(Th1)與第二型輔助T細胞(Th2)〔註〕。巨觀而言,產生這兩種T細胞都是對抗外來物的正常反應。但抗原若主要誘發Th2反應,那麼在遭遇到病毒時則可能會誘發肺、胸腔過度發炎,讓大量體液、白血球浸潤在胸腔,使肺臟猶如溺水一般,反倒令患者症狀加重。
〔註〕被抗原活化的 T 細胞,至少有兩種行為:
Th1 反應:強化巨噬細胞(macrophages)的吞噬效果,主要吞噬外來物。
Th2 反應:增加介白素五號(interleukin-5, IL-5)等 發炎物質、活化嗜酸性白血球(eosinophil),主要排出過敏原。
由於COVID-19也是呼吸道病毒,有了前車之鑑後各大藥廠在設計COVID-19疫苗時的動物、細胞實驗階段,就會先行確認自家疫苗誘發的是Th1反應,以避免1960年代RSV疫苗的慘痛事件再次發生。
數十年的科學進展,對抗原的認知改頭換面
直到電子顯微鏡發明後,人類才能夠真正看到病毒,並且更細緻的理解病毒結構。數十年來經歷多種學科,包含電子顯微鏡、蛋白質結構學、基因工程學等領域的進展,使科學家在研發疫苗時著重於誘發有效中和抗體的觀點也逐漸細緻。對於抗原的概念也從「整顆病毒」轉為「病毒的某蛋白」,再轉變為「病毒某蛋白在某一階段的結構」。
以COVID-19疫苗為例,早在中國武漢爆發疫情之前,科學家就曾針對中東呼吸症候群冠狀病毒感染症(Middle East respiratory syndrome coronavirus, MARS)、嚴重急性呼吸道症候群(severe acute respiratory syndrome, SARS)進行研究,並了解到製作冠狀病毒疫苗最有效的抗原是位於病毒細胞膜上,它與細胞結合之前的棘蛋白(spike glycoprotein)結構〔註〕。為了把棘蛋白「固定」於融合之前的結構,各家藥廠設計的棘蛋白抗原,幾乎都修改了部分胺基酸,以確保疫苗能誘發最大的免疫力,而RSV疫苗的製作其實也有類似現象。
〔註〕簡單來說,棘蛋白身負兩個重任:辨認細胞以及撬開細胞,而「辨認」和「撬開」的蛋白質結構並不相同。
有中和抗體也無法抗感染?RSV之謎
發現RSV病毒後沒多久,人們就觀察到即使感染RSV並痊癒、體內還有抗體仍無法避免再次感染。而在1960年代的疫苗加重死亡事件裡,也明顯觀察到儘管疫苗使中和抗體增加四倍以上,但仍沒有「抗感染」的保護力。當時的科學家對此提出了各種可能的解釋,包括疫苗的中和抗體不足,或是我們對抗體、病毒蛋白、細胞的細微互動還不夠了解等,並持續進行研究。
隨著研究的進展,科學家逐漸發現有些病毒表面的蛋白同時肩負著辨認和撬開細胞的功能,而且這些蛋白還會隨著需求扭轉自身結構。類似新冠病毒的棘蛋白,RSV病毒表面的F蛋白,也同時具備辨認和撬開細胞的兩種功能,並有融合「前」(pre-fusion F)與「後」(postfusion F)兩種結構。
累積了上述的線索和知識後,不免讓人自問:遭遇病毒或注射疫苗後,人體產生的中和抗體是黏住「融合前」的F蛋白,還是黏住「融合後」的F蛋白呢?會不會儘管有中和抗體產生,但卻辨識了「錯誤」的F蛋白使得疫苗與人體免疫力都難以對RSV生效?
即使有了上述推測,但還有個實際的麻煩。那就是融合前的F蛋白非常不穩定,除了難保存外更難以研究,更不用說大量生產為疫苗。
基因工程進展,從最強抗體逆推疫苗設計
最終藉由單株抗體預防感染的研究,為RSV疫苗揭開了另一個線索。透過篩選康復者的抗體,科學家改造細胞,推出預防嬰兒RSV感染和重症的單株抗體西那吉斯(Synagis®)。先讓我們記住這個藥名,它將是研發RSV疫苗的思考關鍵之一。
21世紀初,葛蘭素藥廠發現了三株來源於自然感染者捐贈細胞的不同抗體都能降低RSV對細胞的感染力,且效果比西那吉斯強十倍以上。後續更詳細的研究發現,這些強效的抗體與前面推測的相同,辨識的並非融合後F蛋白。而科學家將抗體和「融合前F蛋白」混合後觀察,發現這三株抗體結合在融合前F蛋白的相同位置上,此位置被命名為抗原位點Ø(antigenic site Ø)。科學家因此推測抗原位點Ø對RSV感染細胞「極度」關鍵,更為此取了個響亮的名字「超級位點」(supersite),且相信這是疫苗開發的最後一塊拼圖。
至此,開發RSV疫苗的考驗便是如何改造融合前F蛋白的部分胺基酸,使它的結構穩定並可供研究與疫苗生產。
隨著基因工程的進展,現在科學家應用多種策略穩定融合前F蛋白,例如新增雙硫鍵固定結構,或新增立體障礙、阻礙結構扭轉等。打造人工修飾的融合前F蛋白後,透過體外實驗等證明了穩定F蛋白結構的思路有效,更重要的是在小鼠上證明了抗感染的能力。後續也成為了葛蘭素、輝瑞(Pfizer)和莫德納(Moderna)發展RSV疫苗的奠基石。
這種以「最佳抗體」倒著推導出「最佳抗原」的反向疫苗學(reverse vaccinology)在未來可望有更多的空間。針對「武器」較簡單的病原,例如病毒有可能是找到最佳抗原以製造疫苗的捷徑;而針對複雜的對手如細菌、胞內寄生蟲等,則可能是尋得最有效療法的策略之一。
自發現RSV起,人類與病毒展開了超過半世紀的攻防。在去年後,尤如動漫《葬送的芙莉蓮》中,人類經過漫長的研究終於破解詛咒一般,我們透過長期的觀察和解析也終於破解了RSV疫苗之謎。
表一|目前和潛在的RSV疫苗
藥商
|
名稱
|
技術別
|
適用族群
|
格蘭素
|
AREXVY®
|
蛋白質疫苗
|
60歲以上
|
輝瑞
|
ABRYSVO®
|
蛋白質疫苗
|
.60歲以上
.懷孕32~36周的孕婦(保護出生後的嬰兒)
|
莫德納
|
暫名 mRNA-1345
|
mRNA疫苗
|
60歲以上
|
延伸閱讀
1. Sadoff, J. et al. (2021). Safety and immunogenicity of the Ad26. RSV. preF investigational vaccine coadministered with an influenza vaccine in older adults. The Journal of infectious diseases, 223(4), 699- 708.
2. Papi, A. et al. (2023). Respiratory syncytial virus prefusion F protein vaccine in older adults. New England Journal of Medicine, 388(7), 595- 608.
3. 蔣維倫。(2022年3月3日)。誘發中和抗體、活化記憶型淋巴球?疫苗與狡猾病毒間的攻防戰。科學月刊。https://www.scimonth.com.tw/archives/5622
RSV疫苗最新資訊
《新英格蘭醫學雜誌》(The New England Journal of Medicine)於今(2024)年3月14日公布葛蘭素RSV疫苗最新研究,發現孕婦接種疫苗後早產機率提高約兩倍(疫苗組約0.4%、3494人裡發生13例;安慰劑組約0.2%、1739例裡發生3例),顯示RSV疫苗可能對孕婦有不良的影響。
儘管疫苗對出生的新生兒發揮了抗感染和重症的效果,但基於非預期的早產率增加,該試驗提前停止。