- 科技報導
文章專區
2020-12-15再生醫學技術大躍進-加入CRISPR技術,遺傳性疾病療效大提升
468 期
Author 作者
陳張源/陽明大學藥理所碩士,臺北榮民總醫院邱士華醫師團隊研究助理。
基因剪刀的應用
榮獲2020諾貝爾化學獎
今年(2 0 2 0)諾貝爾化學獎得主為法國遺傳學家夏彭提耶(Emmanuelle Charpentier)與美國生物學家道納(Jennifer A. Doudna),他們開發俗稱「基因剪刀」的基因編輯技術——CRISPR/Cas9,可以精準地改變動、植物與微生物的去氧核醣核酸(DNA),對分子生物學、創新治療癌症、遺傳疾病與植物育種皆有幫助。
 研究團隊合照,左起邱士華教授、何國牟教授、張家靖教授與黃自強教授。(作者提供)
研究團隊合照,左起邱士華教授、何國牟教授、張家靖教授與黃自強教授。(作者提供)
本文主要談論的,是此技術對遺傳性疾病的影響。這類疾病大多源自於病患本身的基因缺陷,而CRISPR的應用可以把病患突變的基因片段剪下,再進行基因修補,讓病患不再依賴藥物及終身療程,達到根治的目的。患有基因缺陷的病人,如血液、眼睛或是心血管等相關疾病的患者,很多都沒有藥物可以治療,其生命或是生活品質遭受到強大的威脅與困境,即使有可用的藥物,也可能面臨高額的醫療費用以及終生服藥。基因編輯提供了一個創新的治療方式,利用基因剪刀將突變的基因去除,替換成正常的基因,可望能讓患者完全康復,一勞永逸。
當前利用基因剪刀
進行的臨床前試驗與困境
目前,CRISPR技術已嘗試應用在血液、眼睛、肌肉、心肌、肝臟和肺臟等組織及器官的基因治療,但仍處於臨床前試驗。
至於已經進入臨床試驗階段者,主要是針對血液以及眼睛的遺傳性疾病。2017年,瑞士基因編輯公司CRISPR Therapeutics與美國福泰製藥(Vertex Pharmaceuticals)攜手合作,將CRISPR/Cas9推往臨床試驗的階段,並在今年宣稱,首批接受一次性基因編輯療法CTX001的鐮刀型紅血球疾病(sickle cell disease )和β型海洋型貧血症(beta thalassemia)患者,其與貧血相關的指標皆回升、顯現治療效益,且可長達15個月。只是,即便相關應用發展迅速,該產品仍在試驗過程中使兩位患者產生嚴重的副作用,這個問題至今仍待解決。
儘管CRISPR/Cas9技術能有效解決遺傳性疾病患者基因突變的問題,但其所伴隨的副作用,也讓此技術的應用受到限制。產生副作用的原因,主要源自於CRISPR/Cas9用來做運輸的類腺病毒(adenoassociate virus, AAV)還是有一定的風險,正因如此,研究過程中就可能面臨病人過度的免疫反應、需要重複施打與致病性等問題,另外類腺病毒只能夠包裝4.5 kb的DNA,進而使這項技術開發的產品通用性低且難以提升產量。
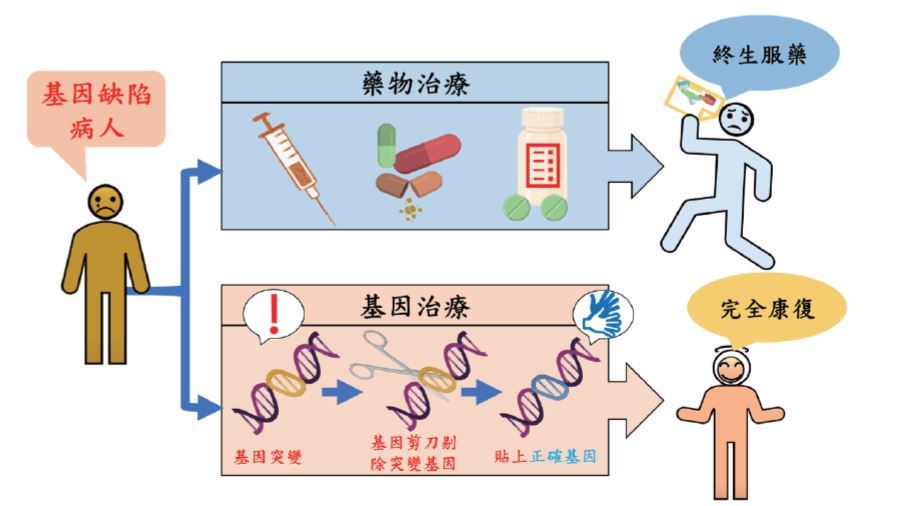
基因剪刀提供了一個創新的治療方式,利用基因剪刀將突變的基因去除,替換成正常的基因,能讓患者完全康復。(作者提供)治療基因病變的創新策略
為解決此一困境,在科技部的支持下,臺北榮民總醫院邱士華醫師團隊(以下稱本團隊)與美國加州大學洛杉磯分校(University of California, Los Angeles, UCLA)跨國合作,將自我組裝超分子奈米分子及奈米探針與CRISPR/Cas9技術結合,針對血紅蛋白(hemoglobin A, HbA)中β-球蛋白的HBB基因突變進行治療。臨床上最常見的血液疾病,鐮刀型紅血球疾病和β地中海貧血,就是因為HBB基因突變,使得β-球蛋白的結構改變或產量降低,進而導致HbA產量或功能異常、難以發揮運送氧氣的功能,目前臨床治療僅能藉由輸血或骨髓移植等方式來控制或減緩病徵,無法完全根治。團隊所用的奈米粒子,是以AD-PAMAM混合CDPEI、AD-PEG所製成,這三種材料會自我組裝成高分子奈米粒子,並可用在運輸DNA或是蛋白質的技術上,再搭配奈米探針能高效率地將完整的HBB基因剪接進入血液細胞內,從而針對血液疾病患者提供一種安全、通用的治療方案。
另外,針對眼疾方面,本團隊也以幹細胞技術基礎,成功建立先天性視網膜裂損症(X-linked Juvenile Retinoschisis, XLRS)病人的誘導性多功能幹細胞(induced pluripotent stem cell, iPSC),並進一步成功分化為立體3D視網膜類器官(3D organoids)。在臨床上,XLRS的發病率約為五千分之一至兩萬分之一,且好發於10歲男童,患者小時候常被誤認為弱視而延誤治療,日後要治療卻以為時已晚,可能會造成視力永久喪失。相關研究顯示,XLRS的發病原因與RS1基因的突變有關,因此,本團隊也與交通大學分子生物與生物工程研究所教授張家靖、成功大學微電子工程研究所教授曾永華合作,開發以奈米鑽石(nanodiamond)作為CRISPR的非病毒載體,並證實CRISPR/Cas9技術能有效應用在具有疾病特性的視網膜類器官中,將RS1基因缺失的類器官「修正」成為正常的視網膜組織,在眼科學中無疑是一大突破。
這兩項研究成果涵蓋多項概念驗證與研究技術突破,包括兩種以奈米技術將CRISPR/Cas9材料有效運送到指定細胞或器官的遞送平台,以及CRISPR/Cas9技術能在長片段DNA序列中以非病毒載體運輸且有更高效率的治療效果。本研究團隊在CRISPR/Cas9與奈米粒子的結合應用上所取得的成果,已於今年4月及10月分別發表在《先進科學》(Advanced Science)與《科學進展》(Science Advances)期刊。
在動物模式上的應用及治療評估
另一方面,為了進一步擴展CRISPR/Cas9與奈米粒子技術的應用性,本研究團隊與陽明大學藥理所教授黃自強、生物藥學研究所教授何國牟以及交通大學生物科技學系教授張家靖共同合作,致力於研究囊狀纖維化(cystic fibrosis)的致病機轉以及CRISPR/Cas9的基因治療應用。囊狀纖維化是一種體染色體隱性遺傳疾病,在患者微支氣管及肺部會有黏液增多且濃稠的情況,很容易成為細菌孳生的溫床,導致肺部反覆發炎感染而有纖維化的情形發生,過去研究亦指出,囊狀纖維化與囊狀纖維化跨膜調節器(cystic fibrosis transmembrane conductance regulator, CFTR)等位基因的突變有所關聯。
黃自強專精於囊狀纖維化生理基礎研究及藥物開發,歷年來該實驗室描述許多疾病突變的病生理機轉及藥物作用模式,在此計畫中,他將利用電生理及分子生物技術,進一步瞭解造成此疾病獨特突變的病生理機轉。此外,本團隊的邱士華也利用iPSC技術,從病患血液中成功培養出帶有CFTR基因突變肺臟的類器官組織,結合張家靖的奈米鑽石技術以及本團隊的CRISPR/Cas9技術,將修正過後的CFTR基因透過顯微注射的方式送回何國牟所飼養的基因轉殖斑馬魚身上,最終評估基因剪輯過後的3D立體肺臟類組織是否能修復CFTR基因缺陷造成的影響,並進一步觀察病理模型、模擬活體中器官發育與生理狀況。

研究團隊正在將立體類器官移植到斑馬魚胚胎身上。(作者提供)

注射肺類器官的斑馬魚。(作者提供)
臨床上,囊狀纖維化的治療藥物成效並不明顯,主要受限於沒有適合的疾病模型,對於藥物發展也有所限制。因此,本團隊利用斑馬魚繁殖快速且基因同源性高的特性,可以大幅提升基因治療的研究進度,並作為未來藥物開發的重要先導實驗。另外,由於iPSC具有能分化成不同細胞的優點,因此透過iPSC技術加上基因編輯的治療平台,能夠運用在多種遺傳性疾病的基因治療與藥物開發。
結論
本研究團隊先前已整合自我組裝超分子奈米分子包覆攜帶CRISPR/Cas9這把基因剪刀,經實驗證實,可大幅提升此技術在XLRS、鐮刀型紅血球疾病以及β-地中海型貧血等疾病的基因編輯效能。而此次3D肺臟類器官結合CRISPR技術在斑馬魚平台上的研究,亦可望為先前的研究再做突破,除了成功開發出以高分子奈米粒子高效能攜帶CRISPR/Cas9的「新式基因精準編輯治療創新平台」,提供血液基因病變疾病或遺傳性視網膜疾病新興治療方向外,更可為肺部疾病的基因治療應用開闢出一條新的道路。未來,期望將這些重要成果早日應用到病人身上,為患者帶來治癒的新希望!