- 封面故事
- 2020年
- 612期-2020諾貝爾獎特別報導(12月號)
文章專區
2020-12-01C肝病毒細胞模型建置的幕後功臣——拉爾夫.巴滕施拉格
612 期
Author 作者
涂琬瑛/畢業於臺灣大學生化科技學系碩士班,曾在中研院生化所做實驗助理,現為巴滕施拉格實驗室的博士生。
自C肝病毒(hepatitis C virus, HCV)在1989年被發現之後,科學家們一直嘗試在體外培養這株病毒。最初他們嘗試將病人的血清拿來感染包括人類肝細胞(primary hepatocyte)的各種細胞株,但這類方法始終無法建立良好的C肝病毒細胞模型。所以他們借助從其他RNA病毒上得到的經驗:將病毒的基因組接到噬菌體啟動子(phage promoter)後面,利用體外轉錄(in vitro transcription)得到病毒基因組,再將基因組送進細胞裡(圖一右側)。
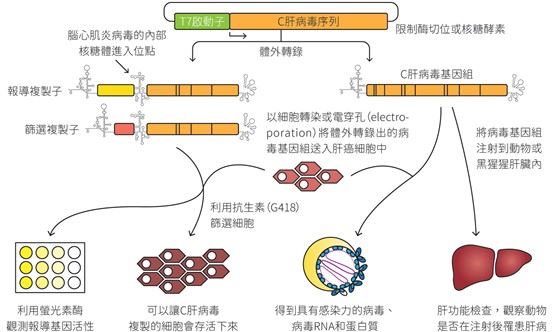 右側:將C肝病毒的全基因組接到噬菌體T7啟動子後面,利用體外轉錄得到病毒基因組,再將它送進細胞。
右側:將C肝病毒的全基因組接到噬菌體T7啟動子後面,利用體外轉錄得到病毒基因組,再將它送進細胞。
左側:複製子模型。將C肝病毒基因組內和複製無關的基因組,換成報導基因和腦心肌炎病毒的內部核糖體進入位點,再接到T7啟動子後面,利用相同方式得到病毒基因組並送進細胞內。
下方:這樣的細胞模型能用來研究病毒複製、宿主細胞反應、病毒蛋白質及基因組結構與相關肝病研究。
理論上進到細胞裡的RNA基因組能夠表現出蛋白質,啟動複製機制,並完成組裝產生有感染力的新病毒顆粒。採用這種策略的好處是能將病毒的基因組保存在質體(plasmid,圖二)裡,方便科學家們進行放大或是修改,甚至可以加上適當的報導基因(reporter gene),讓偵測病毒複製變得更加容易。
 圖二:質體一般指在細菌的染色體DNA(bacterial DNA)以外,另一個能夠自主複製的DNA 分子,常被應用於基因轉殖工程中。(Spaully, CC BY-SA 2.5,Wikimedia Commons)
圖二:質體一般指在細菌的染色體DNA(bacterial DNA)以外,另一個能夠自主複製的DNA 分子,常被應用於基因轉殖工程中。(Spaully, CC BY-SA 2.5,Wikimedia Commons)
這個策略聽起來好像很容易也很理想,但卻花了病毒學家們10年左右的時間才實現。其中,德國病毒學家巴滕施拉格(Ralf Bartenschlager)及他的團隊所建立的次基因組複製子(subgenomic replicon)系統功不可沒。
建立C肝病毒細胞模型的困境就如同其他的團隊一樣,巴滕施拉格的團隊也想利用此策略建立C肝病毒的細胞模型。但在那之前,必須先得到完整的C肝病毒基因組序列,包含病毒RNA的5’端和3’端非轉譯區(untranslated region, UTR),再將病毒RNA進行反轉錄(reverse transcription)和聚合酶連鎖反應(polymerase chain reaction, PCR)放大後轉殖到質體內。
巴滕施拉格先是在1993年從病人血清內,分離並轉殖出兩個接近完整的C肝病毒基因組(除了病毒RNA的3’端非轉譯區)。在得到這段病毒RNA基因組序列後,他們便根據圖一右方的策略,開始建立C肝病毒細胞模型。但很可惜的是,他們在被轉染(transfected)的細胞中,並沒有觀察到C肝病毒複製的情形。……【更多內容請閱讀科學月刊第612期】