- 封面故事
- 2020年
- 604期-冠狀病毒的迫降(4月號)
文章專區
2020-04-01當冠狀病毒入侵—人體內的免疫風暴與致病機轉
604 期
Author 作者
謝世良/中研院基因體研究中心特聘研究員、教育部國家講座教授。宋佩珊/中研院基因體研究中心博士後研究員。
去(2019)年12月1日,在中國武漢開始報導有人被原因不明的病毒感染並產生肺炎。同年12月12日中國中央電視台正式公布在武漢爆發原因不明的病毒感染人體,中國疾病管制局則於12月21日正式宣布中國有群聚感染。今(2020)年1月8日,中國科學家正式宣布發現一個新型的冠狀病毒(coronavirus),1月28日美國國家生物技術中心資料庫(National Center for Biotechnology Information, NCBI)公布第一個新型冠狀病毒的基因組(genome)並命名為Wuhan-Hu-1,從此全世界有正式的新型冠狀病毒檢驗依據。
截至2020年3月,全世界的確診病例已超過30萬例,死亡人數也超過1萬例,即使世界各國政府及人民高度戒備,疫情仍然不斷延燒。除了南極大陸外,世界各洲無一倖免,人類的生命安全也面臨一個空前的威脅。世界衛生組織(World Health Organization,WHO)於2020年2月11日正式命名此疾病為COVID-19,而國際病毒分類委員會(International Committee on Taxonomy of Viruses,ICTV)將造成此疾病的病毒稱作嚴重急性呼吸道症候群冠狀病毒2型(SARS-CoV-2)。
為什麼COVID-19比流感危險?
冠狀病毒屬於冠狀病毒科(Coronaviridae),為帶有外套膜(envelope)的單股正鏈RNA病毒(positive-sense single-stranded RNA virus),分為α、β、γ及δ四個屬,主要造成禽鳥的上呼吸道病變,於家畜則是造成腸胃道腹瀉等症狀。而人類如果感染冠狀病毒的症狀則與感冒相似,主要為上呼吸道感染症狀,例如流鼻水、發燒、咳嗽和鼻塞等。但目前所發現冠狀病毒β屬的中東呼吸症候群冠狀病毒(MERS-CoV)、嚴重急性呼吸道症候群冠狀病毒(SARS-CoV)及最近造成嚴重疫情的SARS-CoV-2,則會造成人類下呼吸道感染,引起嚴重肺炎及呼吸衰竭而導致死亡。
要判斷一個傳染疾病是否容易控制,是依據基本傳染數(basic reproduction number),又稱R0(R naught)的高低。R0指的是當沒有外力介入之下,一個感染者能夠把疾病傳染給多少人的平均數,流行病學通常以R0作為評估傳染疾病是否容易控制的依據數值。以同屬於冠狀病毒的SARS-CoV為例,SARS-CoV的R0值介於2~5之間,表示一個已感染SARS-CoV的人能夠再將病毒傳染給2~5個人。常見的流感病毒R0值介於1.2~1.6之間,然而COVID-19目前的R0值介於2.0~3.8之間。由此可見,COVID-19在疾病傳播控制比流感病毒不易。除此之外,COVID-19與SARS-CoV不但傳染力相似造成防疫困難度增加外,二者的結構也相似,皆以棘蛋白(spike glycoprotein,S)與血管收縮素轉換酶II(angiotensinconverting enzyme II,ACE2)受體結合以感染細胞。
病毒來襲時,身體如何免疫機制?
為什麼COVID-19會對人類的生命造成如此大的危害呢?那就要先了解人體免疫系統對外來的病毒如何產生免疫反應(圖一)。當病毒侵入人體,免疫反應馬上會被啟動,體內自然殺手細胞(natural killer cell)會殺死被病毒感染的細胞,以遏制病毒傳播並產生干擾素(interferon, IFN)抑制病毒複製;隨後巨噬細胞(macrophage)會將病毒的抗原呈現給T細胞(T cell)及B細胞(B cell),以活化毒殺性T細胞(cytotoxic T cell,TC)去攻擊並殺死被病毒感染的細胞,並使B細胞產生抗體與病毒結合,中和病毒感染細胞的能力。這些被病毒活化的T及B細胞,有些會成為記憶性的細胞,若人體再次遇上同樣病毒的侵入,人體免疫系統藉由記憶性的T及B細胞,快速產生高量的抗體中和病毒的感染能力,高量的毒殺性T細胞也同時殺死被病毒感染的細胞,因此病毒很快就被清除。一般的鼻病毒(rhinovirus)及毒性不強的冠狀病毒,人體皆可利用此機轉來清除病毒並使人體恢復健康。
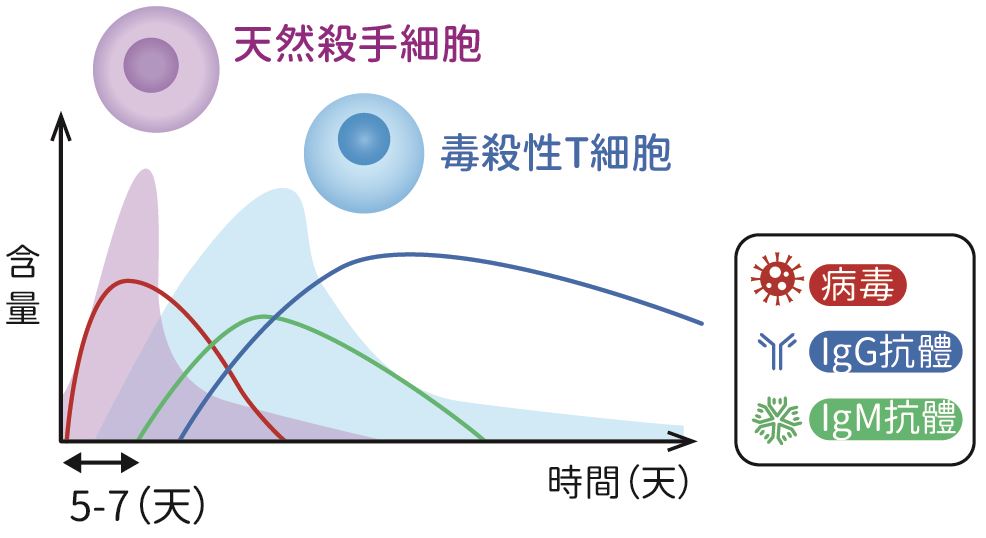
圖一:當病毒侵入人體時,體內的自然殺手細胞會率先啟動,隨後毒殺性T細胞被活化,而B細胞則會產生抗體與病毒結合,中和病毒感染細胞的能力。(宋佩珊提供參考圖繪製)
除了藉由免疫系統對抗病毒,人體內的其他細胞也有對抗病毒的一套辦法。例如當SARS-CoV 感染肺部時,肺部上皮細胞會釋出大量的第一型干擾素及第三型干擾素(Type I & type III IFN),經由干擾素抑制病毒於細胞中的複製;除此之外,上皮細胞會分泌大量的趨化因子(chemokines)吸引免疫細胞進入肺部,造成細胞浸潤 (圖二)。
 圖二:當SARS-CoV 感染肺部時,肺部上皮細胞會釋出第一型干擾素及第三型干擾素,經由干擾素抑制病毒的複製;上皮細胞也會分泌大量的趨化因子吸引免疫細胞進入肺部,造成細胞浸潤。(宋佩珊提供參考圖繪製)
圖二:當SARS-CoV 感染肺部時,肺部上皮細胞會釋出第一型干擾素及第三型干擾素,經由干擾素抑制病毒的複製;上皮細胞也會分泌大量的趨化因子吸引免疫細胞進入肺部,造成細胞浸潤。(宋佩珊提供參考圖繪製)
為什麼COVID-19 這麼可怕?
看到這裡,讀者會不禁疑問,為什麼SARS-CoV-2 會造成嚴重的發炎反應並造成感染者死亡呢?原因在於它是一種全新的病毒,人體並沒有可辨識及中和病毒感染能力的抗體,也無記憶性的毒殺性T 細胞去攻擊並殺死被病毒感染的細胞。此外,此病毒複製能力極強,人體產生的干擾素也無法有效的抑制病毒複製,造成病毒持續複製並藉由飛沫傳染給其他人。但最致命的一點,就是此病毒會產生細胞激素風暴(圖三),使身體產生過度的免疫反應,像是H5N1 病毒(influenza A virus subtype H5N1)及SARS-CoV 等皆會產生此風暴,造成高致死率〔註一〕。
 圖三:病毒在體內不斷複製,使細胞產生許多促發炎激素和發炎因子,並藉由細胞外微囊體的活化刺激巨噬細胞表面的C 型凝集素5A 大量增加促發炎激素,嗜中性白血球也會產生嗜中性球胞外網狀結構,造成血管內皮損傷使疾病更加惡化。(宋佩珊提供參考圖繪製)
圖三:病毒在體內不斷複製,使細胞產生許多促發炎激素和發炎因子,並藉由細胞外微囊體的活化刺激巨噬細胞表面的C 型凝集素5A 大量增加促發炎激素,嗜中性白血球也會產生嗜中性球胞外網狀結構,造成血管內皮損傷使疾病更加惡化。(宋佩珊提供參考圖繪製)
細胞激素風暴的關鍵在於當病毒不斷持續複製時,被感染的細胞會持續產生腫瘤壞死因子(TNF)、介白素- 6(interleukin-6, IL-6)、介白素-1(interleukin-1, IL-1)及其它數十種的促發炎激素及各種發炎因子,例如前列腺素(prostaglandin, PG)、細胞外微囊體及各種內源性的危險因子。這些因子會促成更多的發炎細胞聚集至被感染的肺部上皮細胞持續產生更多量的促發炎激素及發炎因子,並造成肺部的損傷而導致纖維化。
此外,被細胞外微囊體活化的嗜中性白血球也會產生嗜中性球胞外網狀結構 (neutrophil extracellular traps, NETs),造成血管內皮的損傷,導致血管的通透性增加及滲漏。大量的液體堆積在肺泡內造成病人無法換氣而窒息,血壓也因血管內的液體大量流失而造成血壓下降,導致病人休克而死亡。
而在探索細胞激素風暴的成因時,最重要的是「促發炎激素及發炎因子」主要來源是什麼細胞。免疫學家都知道巨噬細胞是促發炎激素及發炎因子的最主要來源,在人體因發炎反應而造成的損傷扮演極關鍵的角色。在之前的研究顯示,H5N1 病毒會藉由刺激巨噬細胞表面的C型凝集素5A(CLEC5A)而大量增加促發炎激素的產生並使疾病更加惡化。因此,SARS-CoV-2 也極有可能類似H5N1病毒,經由刺激巨噬細胞產生細胞激素風暴,使大量發炎細胞聚集在肺部,進而導致血管的通透性增加,最後造成病人無法換氣及血壓下降而死亡。
疫情之下的臺灣對策
COVID-19 疫情嚴重,從目前情況看來已經不限於亞洲,在歐美國家及地球每一個角落(除南極大陸外)快速蔓延,使得全球籠罩在COVID-19 肆虐陰影之中。臺灣政府和中央研究院、衛生福利部疾病管制署、國家衛生研究院、工業技術研究院及各大醫學中心已攜手合作,中研院院長廖俊智更率領各方專家共組COVID-19 合作平台,成立專業顧問團隊,並建立病毒培養平台、抗原平台、檢體平台、病毒分讓平台,提供病毒及檢體以進行快篩檢測試劑(檢測病毒RNA、病毒抗原或血清抗體)的開發,以供臨床診斷檢測。
此外,針對疾病的預防及治療也建立了抗體平台、疫苗平台、老藥新用平台及小分子合成平台。不僅如此,透過動物模式平台更能夠模擬COVID-19 於生物體內造成的病症,是藥物及疫苗開發不可或缺的一環。這些平台能夠協助科學家更全盤了解COVID-19 的致病機轉並幫助開發治療藥物。
法規方面則建立了智財平台以協助發展藥物及疫苗上市,而社會倫理與法律平台則從社會倫理及法律角度切入,以完善對抗COVID-19 疫情所需的倫理法規。這些平台替臺灣建立起牢固的防疫網,同心協力守護臺灣人民,期望在不久的將來能在對抗COVID-19 的戰役中獲勝。
除了關心2019 冠狀病毒疾病,你還可以知道的是…
免疫系統猶如軍隊,對人體的保護至關重要。因此,國際上將每年的4 月29 日訂為國際免疫日(The International Day of Immunology),這是國際免疫學聯席會(The International Union of Immunological Societies, IUIS)自2005 年發起、2007 年開始全面推廣的活動,旨在提升全球民眾對於免疫學的認知。透過各國免疫學會舉辦研討會與學術交流、中學生科學營隊、實驗室參訪或博物館展示等活動,讓學生與民眾了解人體免疫反應和對病原菌感染的抵抗力、過敏或自體免疫疾病,甚或是癌症、心血管疾病或阿茲海默症等,都有密切的關係。不僅如此,也提供免疫學最新研究與創新的醫療方法,例如疫苗開發、基因轉殖、組織移植和抗體或細胞治療等的重要貢獻。
〔註一〕詳細機制可參考〈細胞激素風暴:失控的免疫反應〉演講,https://scitechvista.nat.gov.tw/c/sgnM.htm
延伸閱讀
1. Teng, O et al., CLEC5A-mediated enhancement of the inflammatory response in myeloid cells contributes to influenza pathogenicity in vivo, J. Virology, Vol. 91: e01813-16, 2017.
2. Sung PS and Hsieh SL., CLEC2 and CLEC5A: pathogenic host factor during acute viral infections, Front. Immunol., Vol. 10: 2867, 2019.
3. Schulz C, Gabriel G and Kockritz-Blickweede M, Detrimental Role of Neutrophil Extracellular Traps during Dengue Virus Infection, Trends in Immunol., Vol. 41(1):3-6, 2020.