- 精選文章
文章專區
2015-12-01物種基因剔除技術爆炸性的新突破─ CRISPR/Cas9技術淺談
552 期
Author 作者
林翰佐 銘傳大學 生物科技學系助理教授
前傳─故事得從「基因剔除鼠」開始講起⋯
物種基因剔除技術是生命科學研究上的一種終極手段,用來了解特定基因在生命發展過程當中扮演的角色。就如你對別人的好,往往都是你不在身邊時,別人才有清楚的感受一樣,透過抑制特定基因表現的手段,我們可以藉由觀察胚胎或動物生理上的變異情形,進而瞭解該基因的運作。想要在動物身上進行基因剔除,最著名的莫過於「基因剔除鼠」(knockout mice)的技術。這個運用基因同源性重組(homologous recombination)的原理,以及胚胎幹細胞(embryonic stem cells)培養 所組合而成的龐大生物工程,在發展的三十餘年間,滿足了科學家們對研究上的需求。據悉,到目前為止, 科學家們透過這個技術在老鼠的基因體(genome)當中,研究了逾半(約1萬多個)的基因,對人類生命科學的貢獻難以計數。也因此,在2007年的諾貝爾生醫獎,特別授與當初提出相關構想的卡佩奇(Mario Capecchi)等三位教授。
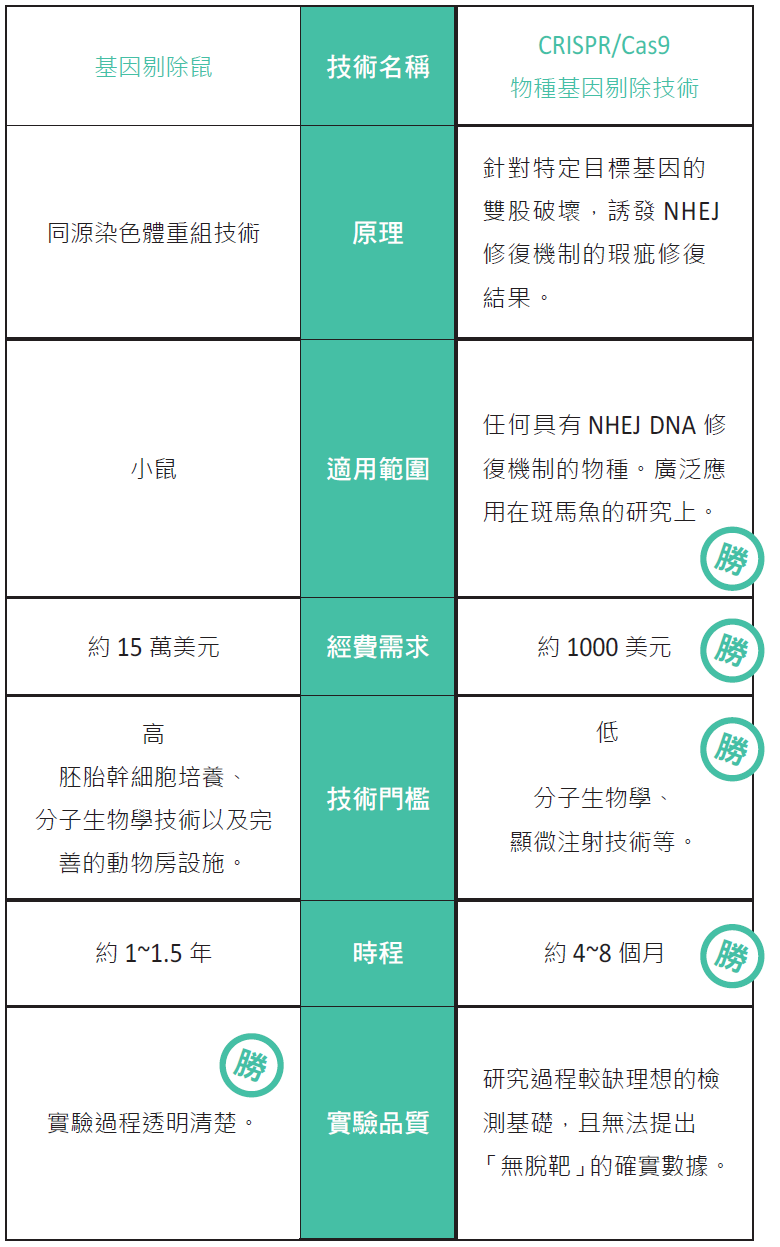
就科學與技術的角度來看,基因剔除鼠的研究設計十分完美,科學家們得以運用分子生物學研究工具,精確的掌握實驗的每一個階段,過程透明,沒有灰色地帶。若說有甚麼問題的話,我想應該是複雜的工序、過高的技術門檻以及龐大資金的需求,這使得基因剔除鼠淪為大型實驗室專屬的研究工具,成為研究奢侈品。直至目前為止,一件訂製基因剔除鼠的專案,價格仍高達15 萬美元,所以市場上仍有一大部分的研究需求無法由基因剔除鼠技術獲得。在2010年前後所發表的CRISPR/Cas9物種基因剔除技術,恰恰彌補了市場需求上的不足,所以短短五年的時間內即有爆炸性的發展,成為學術界的新趨勢。
兩項重要關鍵
在進一步談論主題前,我首先解釋一下物種基因剔除技術在發展上的兩項重要關鍵,分別為(1)具有找到目標基因的方式(gene targeting),(2)具有破壞或取代目標基因的方法。在基因剔除鼠的技術當中,科學家們用一段與目標基因「相似但不完全相同」的DNA補丁(patch)與目標基因互換, 藉此來改變目標基因的表現,而近年來的新興基因 剔除技術,主要是利用源自原核生物體內的一些 DNA內切酶(如後文的Cas蛋白)攻擊特定DNA 所產生的破壞來達到類似的效果。基因剔除鼠的同 源性重組原本就是一種具有專一性置換的方法,缺點是成功機率很低,約只有百萬分之一,所以科學家們巧妙的整合胚胎幹細胞的培養、基因轉殖以及細胞篩選的手段來提升成功機率。而新的方法中則 歷經鋅指核酸酶(ZFN)與類轉錄活化因子核酸酶 (TALEN)技術,終至CRISPR/Cas9技術始大放 異彩。基因剔除鼠與CRISPR/Cas9技術之間的差 異,在表一中做了整理,方便讀者參考。
表一:基因剔除技術大PK。
本篇─在細菌身上所發現的免疫機制
CRISPR/Cas9的全名為「常間回文重複序列叢集關聯蛋白」(clustered regularly interspaced short palindromic repeat/ CRISPR associated protein 9),這個名稱主要是源自細菌以及古菌身上的免疫系統。目前我們所理解的運作方式如圖一,主要是對抗外來DNA(如噬菌體)的入侵,Cas蛋白會辨認外 來DNA上的特徵,然後將其水解消滅。不過,故事並非到此結束,為了增進抗病的效率,多數的免疫系統均會發展它們獨特的「記憶」,CRISPR 系統也不例外, 外來病源DNA並不會完全被水解殆盡,而是經過加工後,被鑲嵌在細菌自己的基因體中。這個稱為CRISPR array的特殊區段能夠轉錄,成為一張「嫌犯名單」,而系統中的Cas III蛋白則會利用這些RNA片段去辨認 可疑的DNA片段,並消除吻合序列的目標。
整個機轉中,Cas III蛋白的獨特能力受到科學家們的 青睞,很適合作為物種基因剔除技術的元件,其中Cas9 蛋白最為常用,CRISPR/Cas9的名稱便是由此而來。
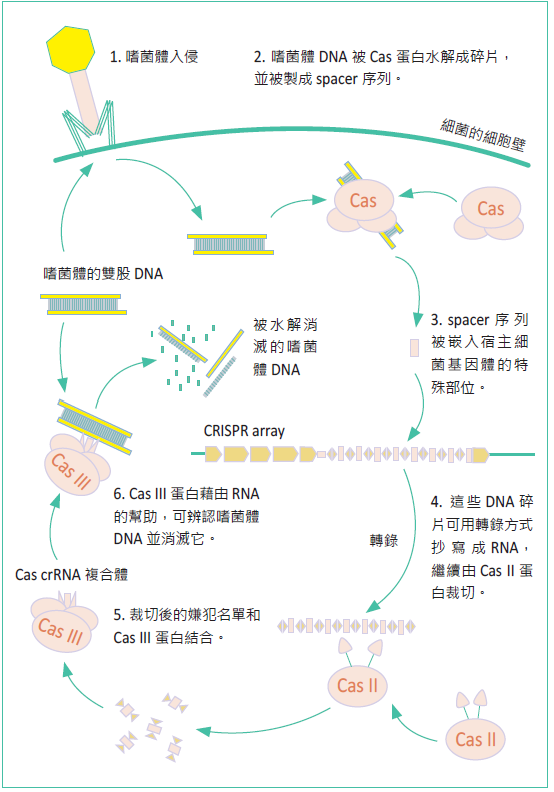
圖一:細菌中CRISPR/Cas9的免疫防禦機制。(Crispr" by James atmos - Licensed under CC BY-SA 3.0 via Wikimedia Commons)
雙股 DNA 斷裂的修復機制
簡單的說,CRISPR/Cas9技術就是利用Cas9蛋白質 可切割特定的基因,來達到基因剔除。不過,單單切割 DNA,就可以抑制DNA表現嗎?對細胞來說,雙股 DNA斷裂是一種嚴重的傷害,細胞必定會執行修復, 想要完整修復,需要有適合的「參考範本」,像是雙股DNA的對向互補股,我們相信,在演化上,DNA以雙 股螺旋方式存在的道理源自於此。當DNA的雙股同時 斷裂,將會失去DNA訊息的連續性,這就成為一個棘手的問題,目前已知細胞可經由兩種途徑進行修復(圖二)。傳統的途徑稱為雙股同源互換(homologous recombination),主要是向另一條同源染色體「借」 一股DNA作為參考基礎(模板),然後完美修復受損 的DNA;不過本文關注的焦點,是另一套系統,稱為非同源互換端點黏合系統(non-homologous end joining, NHEJ)。相較於前者,這套系統的修復顯得有些草率,它藉由特殊蛋白質結合上雙股DNA斷裂的斷口,然後把這些DNA「黏起來」,中間並不包括去 辨認任何的DNA序列。即便NHEJ系統聽起來十分粗糙,事實上這是因應危機處理上的權宜之計,在細胞分 裂的狀況下,發生雙股斷裂會造成複製的染色體無法完 全分配。因為NHEJ系統草率的修復,所以很多時候 會在斷口附近遺失一到數個DNA分子,形成「缺失」 (deletion)突變。如果接點在某個基因當中,缺失突變可能會發生密碼子的「框架移動」(frameshift), 意思是,這個基因無法合成對應的蛋白。
圖二:CRISPR/Cas9攻擊目標DNA所誘發之DNA修補機制的可能結果。
CRISPR/Cas9技術的原理,就是藉由Cas9蛋白攻擊目標基因,誘發細胞體內的雙股DNA修補之後產生有瑕疵的修復結果,因而達成基因剔除。
CRISPR/Cas9技術應用上的優缺點
其實就方法學上,利用新的基因尋標(gene targeting)以及藉由酵素攻擊特定基因誘發細胞NHEJ的不完美修復的設計,都並非為CRISPR/Cas9 技術首創,早期的鋅指核酸酶(ZFN)以及類轉錄活 化因子核酸酶(TALEN)的技術,均有相似的概念,尤其TALEN對目標基因的精確度,至今仍為其他新興方法所難望項背。CRISPR/Cas9技術之所以會受到相當的青睞,主要的理由是因為它採用核酸作為辨認目標基因的工具,這使得實驗操作成本得以大幅度的降低。針對特定基因來製備TALEN對應蛋白,合成費用約需1萬美元,但使用CRISPR/Cas9技術,成本可以下降到1000美元。而且CRISPR/Cas9技術在目標基因序列上的寬容度更高,不會受限於某些DNA序列的組合。由於並不需要使用胚胎幹細胞,這使得包括 CRISPR/Cas9技術在內的新興基因剔除技術可以廣泛的運用在各種生命體當中,並不像基因剔除鼠技術只能在小鼠當中進行。
聽起來,新興技術似乎十分的美好,不過這些方法也不是沒有「死穴」,它們最大的問題在於過程的不透明。 如前文所述,基因剔除鼠是以一段DNA補丁置換的方式處理成不活化的基因,特殊的DNA可以利用聚合酶鏈鎖反應法(PCR)驗證小鼠身上是否具有這樣的補丁,來確認實驗的成功性。而CRISPR/Cas9技術的驗證方式,除了在基因接合位置附近的缺失之外,並不會有其它外加的DNA序列標記可作為後續PCR檢驗的基礎,當在討論「脫靶」的可能性時,這項弱點使得證據力變得更加的薄弱。所謂「脫靶」,是指除了在目標基因之外,Cas9攻擊其他基因的可能性,這點在基因剔除鼠的研究中很容易被證明,但在這些新興的方法中,簡直有如海底撈針般困難。
結語─學術界的階級革命 CRISPR/Cas9技術從2010年被提出後,在短短的數年間即成為學術研究上的主流,除了方便操作、價格便宜之外,更具象的,它掀起了生命科學學術界的一場階級革命:原本只屬大型實驗室才能負擔的物種基因剔除研究,轉而成為普遍研究室都可以進行的實驗。資源、財力以及技術門檻在此一舉被攻破,我想這是 CRISPR/Cas9技術在最近能如此竄紅的主因。
基因剔除鼠以及CRISPR/Cas9技術有如光譜的兩端, 一端以精確透明的實驗流程見長,另一端則以價格優勢、低技術門檻取勝。你,會想用哪種方法呢?