- 科技報導
- 焦點話題
文章專區
2023-09-15再生醫療雙法草案遭遇卡關?臺灣再生醫療發展面臨的爭議與挑戰
501 期
Author 作者
廖秀蓉/亞東紀念醫院醫學研究部研究員;張至宏/亞東紀念醫院副院長;黃奇英/陽明交通大學生物藥學所特聘教授兼所長
再生醫療在臺灣是一個令人矚目的新興領域,主要透過再生醫療製劑和再生醫療技術,利用細胞的再生功能來治療疾病和修復組織損傷。為管理此類醫療實施,2019年修訂的《特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法》(簡稱「特管辦法」)中規範,針對特定的細胞治療項目進行管理、施行的醫療單位,須申請核准提出具體治療方法以及收費標準〔註〕。近來熱烈討論的「再生醫療雙法」草案,為《再生醫療法》及《再生醫療製劑條例》兩個草案的合稱,法案當中的管理方針即衍伸自特管辦法,主要目的是為了維護病患權益和醫療安全及品質,將細胞治療分成了「醫療技術」與「醫療製劑產品」進行管理。雖然再生醫療有許多好處,但仍面臨一些疑慮和挑戰,導致目前的發展進程遭遇一定程度的卡關。本文接下來將列點說明相關的爭議與挑戰。
〔註〕特管辦法除了前述內容外,也會要求施行單位每年繳交成效報告給衛福部審核。而推動再生治療需由政府與學術機構、學會,以及醫療機構和生物技術公司共同合作,促進知識和技術的共享,以完善自體細胞在再生醫療方面的法規制定,包含蒐集臨床前和臨床試驗、治療的效果評估文獻佐證,皆須經過嚴謹監管與審查,並需定期審查和更新規章和政策。
再生醫療雙法面臨的挑戰及爭議點
一、為什麼再生醫療需要使用異體幹細胞?
再生醫療通常需要大量的細胞來進行組織工程或器官再生,然而目前臺灣已經開放進行的「細胞治療」以自體細胞為主,缺乏足夠的合適細胞來源(超級捐贈細胞者),也無法大量製備可用於治療的細胞以滿足再生醫療的需求。缺乏的原因主要是由於現行細胞療法對於幹細胞的應用有許多法規限制,導致細胞的潛在供應量不足。其次,考量再生醫療涉及的倫理和道德疑慮,也需要避免社會經濟誘因造成細胞來源地下化氾濫,或者使用胚胎、胎兒幹細胞的爭議等問題。為了增加合適且合法的細胞來源,必須考慮使用異體幹細胞。
但若異體幹細胞的捐贈者遭受病毒感染或身上帶有其他傳染病,病原體就可能通過幹細胞傳播給接受者,帶來潛在的健康問題。因此,再生醫療在執行上需要詳細並審慎的制定異體捐贈者的篩選標準。
二、接受再生醫療經過長時間之後,會不會有不良影響呢?
在臺灣已經上路的細胞治療由特管辦法管理,所核准的特定細胞治療技術、特定美容醫學手術等應用,都是基於充分的科學依據和臨床實證文獻,使用的技術經過科學研究和試驗,因此具有可靠的效果和安全性。而比特管辦法管理的細胞療法更進一步的再生醫療,它的安全性和有效性當然也必須經過嚴格的評估和臨床試驗來驗證。
不過,醫療方案的建立都需要大量時間、資金和病患參與,並且一步步解決許多醫療上的挑戰。舉例來說,再生醫療需要確保再生組織或器官的正常功能和適應性。因此必須建立完善的監測和評估機制,以確保再生醫療技術的執行效果和安全性得到持續監測和評估。追蹤患者的治療結果、不良事件報告和分析皆是相當重要的一環。
但是,目前特管辦法對於細胞治療成果與追蹤效果的公開程度是否足夠與完全?各界對此仍存在疑慮,尚未達成共識。因此再生醫療是否應該採取類似的管理機制,還有許多討論的空間。
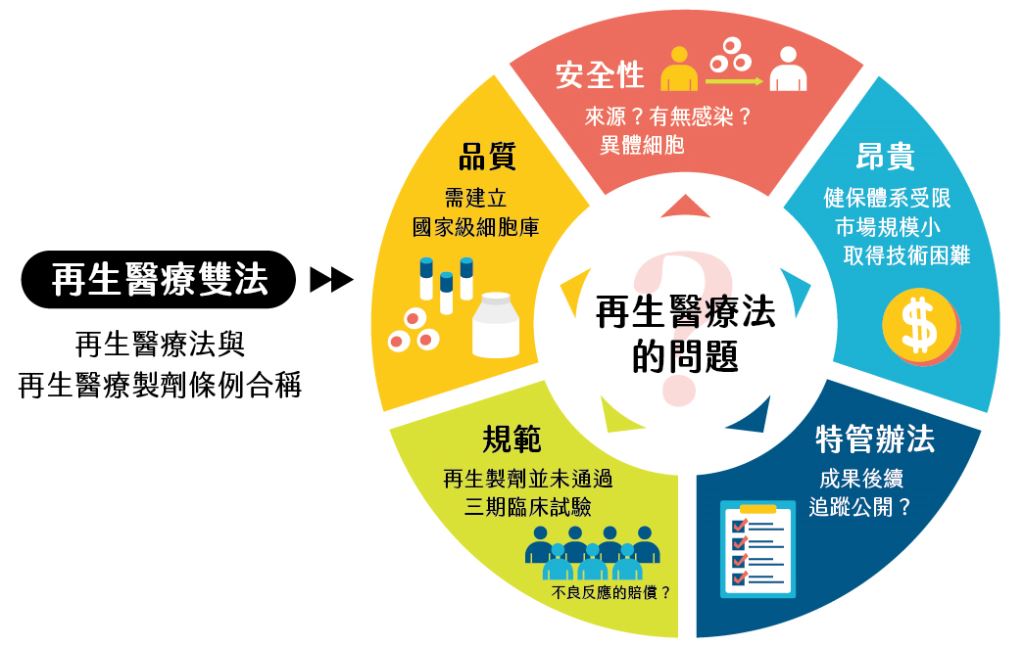
再生醫療雙法目前存在的爭議與疑問
(資料來源:作者提供)
三、再生醫療產品為什麼昂貴?
現階段的再生醫療產品相對昂貴。除了在發展階段,研究發展和生產再生治療產品勢必需要投入大量的資金,而且維持細胞品質必須投入大量成本外,臺灣醫療健保體系與小規模的市場也限制了整體的發展性,對於再生醫療法的商業化和市場可行性也是一個挑戰。
目前,部分地下業者陸續提供民眾無合法認證的細胞治療產品(包括細胞及細胞衍生物),產品雖有標示內容物,但是皆未經過各種試驗與認證。即使價格相對便宜,但產品本身的安全性以及保障仍有待確認。由於大部分非醫療背景的民眾缺乏辨識細胞治療產品是否安全的能力,因此急需政府規劃、制定法規規範立法並確實執行,以確保再生製劑的產品品質。
四、為什麼再生醫療需要國家級細胞庫?品質標準如何建立?
建立國家級細胞庫對於再生醫療發展來說相當重要,有利於開發異體細胞或相關衍生物的應用。國家級細胞庫可收集特定類型的異體細胞,例如幹細胞、造血細胞、免疫細胞等,並確定這些細胞的應用範圍,有利於進一步的開發應用,但在執行與法規上也將帶來許多挑戰。
在執行與規畫上,首先必須確保建立細胞庫的計畫符合我國的法規和倫理標準,這包括隱私保護、細胞來源的合法性、捐贈者知情同意等。其次,需要建立收集機制,從捐贈者中收集異體細胞,需包括捐贈者的登記和適當的樣本採集程序。再者,細胞庫需要完整的設備和設施儲存細胞,並確保安全性和可用性。因此,必須建立一個有效的細胞庫管理系統,追蹤細胞的來源、儲存方式和可用性。同時也需要建立數據庫記錄捐贈者的相關訊息,以及每個細胞樣本的特性和保存情況。最後,為了控制細胞品質、確保細胞庫中的細胞品質符合標準需採取必要的措施,包括定期檢查細胞的完整性、功能性和汙染情況,以確保細胞的品質。
五、再生製劑與藥品差異在哪?須符合相關管理規範嗎?
目前針對再生醫療雙法的討論和爭議眾多,其中討論最熱烈的一項就是再生製劑的管理。再生製劑與藥品製作的方式並不相同,因此由醫師在醫院內將再生製劑施行於病患的方式,被認為不完全適用於《藥品優良調劑作業準則》規範。
現階段對於再生製劑的管理,臺灣規劃採取特管辦法的管理架構,由衛生福利部(簡稱衛福部)直接審查醫院提出的申請案,而非由醫院自行審查。衛福部審查基於人體試驗的累積安全性和有效性結果,醫院則須登錄相關資料以供後續監督〔註〕。
〔註〕醫院獲得核准執行細胞治療技術,必須將相關資料登錄至衛福部細胞治療技術登錄管理系統,包括個案治療成效資料、細胞品質紀錄、非預期嚴重不良反應通報以及年度執行結果報告等。這些措施的用意在確保細胞治療技術的安全性與有效性,並加強監督和管理相關醫療活動。特管辦法的細胞治療與藥品最大不同點在於,細胞治療被歸類為醫療技術而非藥品,醫師們因應病患需要療程需要考量符合病患的細胞製成,法規範重點中有提到,體外處理細胞均需要符合品質管制標準。
然而,部分藥界專家認為再生製劑須依照藥品的製作規範並遵循藥品優良製造作業規範(good manufacturing practice,GMP)認證,且執行再生醫療過程(包括施行於病患上)也同樣需要遵循《藥品優良調劑作業準則》,並經由藥師監督。另外,合格的藥品需有完整的三期臨床試驗,並取得藥品許可證;但再生製劑若是僅透過文獻佐證或通過二期試驗後即取得暫時性核准就施行於病患上,程序上沒有經過三期臨床試驗,有專家認為產生不良反應的顧慮較高。然而,細胞產品的製造與小分子藥物的製程並不相同,若一定要比照小分子藥物經過三期臨床試驗,可能會有執行上的困難,將面臨耗費巨大資金、難以取得對照組、曠日廢時以及導致研發延宕等問題。
理想與現實間的平衡,有賴立法者明智的決定。當政府推動再生醫療法時,針對再生製劑的定義和相關法規應該進行充分的探討和討論,以確保制定適當的監管措施,既能保障民眾安全又能促進再生醫療領域的發展。另外細胞治療產品可能無法適用藥害救濟以保障病患權利,也應設計相當的補救規定。
六、醫療機構設置細胞製備公司,是否有利益衝突與倫理疑慮?
目前特管辦法中「細胞治療技術計畫」的細胞製備場所(cell process unit, CPU)需向衛福部申請通過實地查核,由衛褔部核發人體細胞組織優良操作規範(good tissue practice, GTP)認可函。細胞製備場所對於製備的每一批細胞製品放行前均須依照品質規格,進行標準檢驗並提出檢驗報告作為放行的依據。除了少數大規模財力雄厚的醫療機構,現在臺灣的醫療機構,大部分採取與CPU簽約合作的模式,以避免負擔GTP實驗室的設置與維護的人力物力成本,但也因此使得醫療機構的研究與構想受制於CPU公司。
目前的再生醫療法草案有開放空間,醫院可選擇成立具有營利性的再生醫療生技醫藥公司,結合本身的研究量能,開發屬於自己的再生醫療技術與製劑。但是也有人擔憂醫院可能往規模經濟利益取向,誘導無效醫療或者誇大療效,影響真實再生醫療效果的判定。這當中的利弊得失,取決於立法採取興利或防弊的態度,以及是否有適當的監管措施。
建構優質再生醫療發展環境,為臺灣醫療帶來更多選擇
再生醫療雙法對於未來使用自體/異體細胞(幹細胞、免疫細胞)及細胞衍生物進行治療發展,將帶來重大改變。政府應制定嚴謹的政策和法規,並建立監管機構與機制以加強監督細胞及相關衍生物的品質控制,確保接受再生療法病患的安全性和可行性。學界與產業界也應加強基礎和臨床研究,投資資金和資源支持相關領域的科學研究,以推動再生醫療的發展。醫療院所也可透過加強培訓課程,使醫護人員能夠認識和應用再生醫療雙法的最新發展。對於民眾認知推廣,可以透過舉辦衛教活動、開展科普講座、提供媒體資訊等方式,解答疑問以減少誤解和不確定性,加強再生醫療雙法的宣傳和教育。
政府、研究機構、醫療機構、學會和民眾等多方參與者可以透過與其他國家和地區的專業機構、研究團隊和產業界建立聯繫,分享經驗和資源,才能共同推動再生醫療法的發展和應用。期待透過各方的努力和參與,合作和溝通與協調,早日讓再生醫療雙法通過立法,建構優質的再生醫療發展環境,為臺灣醫療帶來更多的選擇。