- 精選文章
文章專區
2013-02-01永續化學與生活─鞭炮與煙火
518 期
Author 作者
劉廣定/台灣大學化學系名譽教授
喜慶日與年節常以燃放鞭炮(亦稱爆竹或炮仗)和煙火(亦稱燄火或花火)增加歡樂及熱鬧的氣氛,尤其是夜晚天空中發射出造型奇美、燦爛繽紛的煙火更為大眾所喜愛。
這已是中華文化的一部分,而且燃放鞭炮和煙火必需的火藥乃是我國對世界文明極有貢獻的四大發明之一,產生煙火的焰色反應也是中國人最早發現的。十年前(2003 年)本刊第34 卷第2 期曾以專輯介紹「火藥與煙火」,本文則自基本原理,以及從永續化學觀點的新發明,予以補充。
科學史的回顧
可能在漢魏時期中國人就用火燒竹,以發爆裂響聲,故稱「爆竹」或稱「爆仗(杖)」,後用火藥引爆,與火砲相似,故又稱炮仗。所謂「火藥」者,即遇火能燃燒的藥物。中國人發現火藥的時期,大約不會早於公元九世紀初。唐人牛僧儒(公元779~848 年)的《玄怪錄》有北周至隋時人「杜子春」的故事說:他到「波斯邸」訪一鍊丹老人,在鍊丹爐旁睡著,做惡夢大叫驚醒。可能因打翻丹爐以致「紫燄穿屋上,天火起四合,屋室俱焚。」〔註一〕五代人鄭思遠於《真元妙道要略》裡說:「有以硫黃、雄黃合硝石并蜜燒之,焰起,燒手面及燼屋舍者。」都可說明發現火藥的大約時期。
中國人雖然發明了火藥,宋代製成火器,也經由阿拉伯人傳到歐洲,但一直不明其原理。到了明末,對火藥作用的解釋仍是:「硝性至陰,硫性至陽,陰陽兩物相遇於無隙可容之中,其出也,人物膺之,魂散驚而魄齎粉」(《天工開物》)。據此,硝石和硫磺就可製成火藥,完全忽略了「炭」的必需性 。因此導致中國火藥的爆炸力低,產生不出所謂「黑火藥」(Blackpowder 或gunpowder)的「硝6、硫1、炭1」(重量比,約1635 年)或「硝7.5、硫1、炭1.5」(重量比,約1781 年)配方。而且西方從黑火藥到雷酸汞(Mercury fulminate, Hg(CNO)2),苦味酸,硝化甘油,硝化纖維素,三硝基甲苯……,不斷進步。所以,發明火藥的中國人後來反要向西方人學習製造火藥的方法了。
用火藥引發的「煙火」大約始於南宋孝宗時期(公元1163~1189 年),在利用火藥於戰爭的火器之後。藉不同金屬化合物燃燒時火焰顏色不同的特性,也就是所謂的「焰色反應」。不同物質的焰色反應也是中國人最早發現的。
我國很早就將金石礦物用於醫藥,但是古時沒有化學分析,一般只憑礦石的外觀、顏色來判斷和區別不同之物。例如《神農本草經》所載「玉石類」藥物中有芒消和消石,現已知前者是水合硫酸鈉,後者是硝酸鉀,藥性不同,作用亦異,唯憑外形難以區分。唐高宗顯慶四年,(公元659 年)所頒布世界第一部藥典《新修本草》中就有鑑定硝石的方法,該書卷三所載,「消石」(現稱「硝石」)有註記云:「強燒之,紫青煙起,仍成灰,不停沸如朴消,云是真消石也。」可說是世界上第一個見於記載的「焰色定性反應」。
鞭炮的簡單原理
鞭炮由火藥製成。火藥須含引火劑,氧化劑,還原劑,且須反應快,釋放大量反應熱,及產生大量氣體。從重量比「硝6、硫1、炭1」來看,反應式約為:
其中硫黃為引火劑,硝酸鉀(硝石)為氧化劑,焦炭為還原劑(燃料)。一般都以硝石65~75%,焦炭15~20%和硫黃10~15%為配方,但理論的最佳重量比例約為84:8:8,其莫耳比約為硝酸鉀(10)、硫(3)、碳(8)。故反應式為:
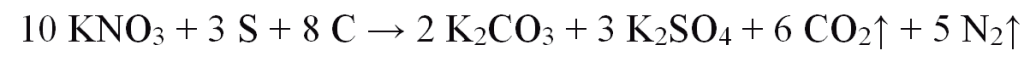
燃燒後瞬間釋放大量熱能(約685 kcal/kg),又產生大量氣體。有人認為實際上常用的「焦炭」並非純「碳」而是C7H4O ,理論的反應式應為: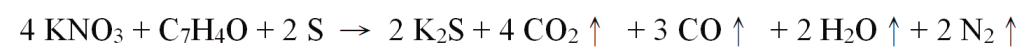
也有人認為純焦炭(C)會吸一些水,而發現75.7%硝酸鉀、11.7%焦炭、9.7%硫磺和2.9%水的反應式為:
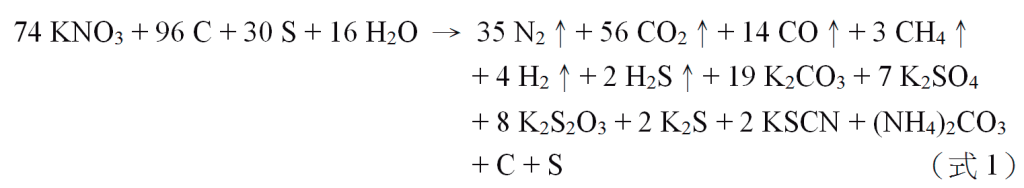 此化學反應在0.01 秒之內,或更快即完成,因瞬間產生大量氣體而體積急速膨脹,又釋出很多能量使溫度驟升。在鞭炮有局限的空間內(即前引《天工開物》所謂「無隙可容之中」)產生高溫、高壓,造成劇烈的「爆炸」現象,產生巨大爆震波。又由上式知同時產生大量固體顆粒,包括未用盡之焦炭和硫磺。
此化學反應在0.01 秒之內,或更快即完成,因瞬間產生大量氣體而體積急速膨脹,又釋出很多能量使溫度驟升。在鞭炮有局限的空間內(即前引《天工開物》所謂「無隙可容之中」)產生高溫、高壓,造成劇烈的「爆炸」現象,產生巨大爆震波。又由上式知同時產生大量固體顆粒,包括未用盡之焦炭和硫磺。
除硝酸鉀外,其他一些硝酸鹽、氯酸鹽、硫酸鹽和過氯酸鹽等亦可用為氧化劑,其條件是反應快、含氧量高、密度大、高生成熱、安全、及吸濕性小。實用上則還要考慮價格的因素。再者,只有硝酸鉀和焦炭也可引起爆炸,
甚至亦可使用其他還原劑(燃料)如鋁粉, 鎂粉或鋁鎂合金(Magnalium, Mg-Al 50/50)等代替一部分或全部焦炭。
有關火藥與下節簡介的煙火原理與應用等,屬於「煙火技術學(pyrotechnics)」之一部分,除民眾生活外,在軍事上也很重要〔註二〕,不贅述。
煙火色彩的簡單原理
五光十色兼有「哨音」效果(whistle effect)的煙火除火藥外,還需要生成彩煙的發煙物,因燃燒而產生不同焰色反應的發色劑與閃光劑,能因特殊燃燒作用而產生哨音的化合物,以及粘合劑(binder)等等。〔註三〕本文限於篇幅,只簡述產生色彩之原因。
金屬單質或其化合物燃燒時氣化,金屬原子或離子的電子受激發升到高能階,再發射能量降至較低的能階(圖一)。其能量變化 ΔE= hν= hc/λ 若此能量在可見光區(波長λ=380~780 奈米,表一),火焰有顏色,即所謂焰色反應。不同金屬產生的火焰呈現不同顏色,產生焰色的強度也不同,因而可以辨別不同的金屬。這即為上述「焰色定性分析」之原理,也是煙火「發色劑」的生色原理。
圖一:(A)電子能階遷移示意圖(B)鋰原子電子能階遷移圖。
……【更多內容請閱讀科學月刊第518期】
註一:宋朝初年李昉所撰《太平廣記》(卷16)記此故事出於唐人李復言(公元775~833年)之《續玄怪錄》。
註二:Conkling and Mocella, Chemistry of Pyrotechnics, 2nd Edition, 2011, CRC Press.
註三:Russell, The Chemistry of Fireworks, 2nd Edition, 2009, RSC.