- 精選文章
文章專區
2013-08-01老化研究的挑戰:如何尋覓自由基的中庸之道?
524 期
Author 作者
周成功/長庚大學生物醫學系講座教授。
長久以來,細胞內的活性氧類物質(Reactive Oxygen Species, 簡稱ROS)被認為是老化重要的推手。一般認為ROS會與細胞的DNA或細胞膜作用造成傷害。如果細胞修補不及,傷害就會隨著年歲的增長而累積,最後導致個體的老化。如果這個理論是對的,那麼用抗氧化劑來減少ROS不就應該可以延緩老化的過程?這也許解釋了為什麼抗氧化劑在當前健康食品產業中如此火紅!但是ROS真的在細胞中一無是處,必須除之而後快嗎?近來許多研究結果告訴我們,ROS的生理角色遠比我們想的複雜,值得關注。
ROS包括超氧自由基(superoxide, O2-)、羥自由基(OH-)和過氧化氫(H2O2)等化學性質活潑的含氧物質。其中超氧自由基在細胞中有兩個主要來源,一是在粒線體中電子傳遞鏈在傳送電子過程中不慎與氧接觸而產生;另一則是細胞膜上的NADPH氧化酶,它會將NADPH上的電子傳給氧而形成。為了防止過多的ROS產生,細胞發展出超氧歧化酶(superoxide dismutase, 簡稱SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase)及過氧化氫酵素(catalase) —— 來分解這些過氧化物(圖)。
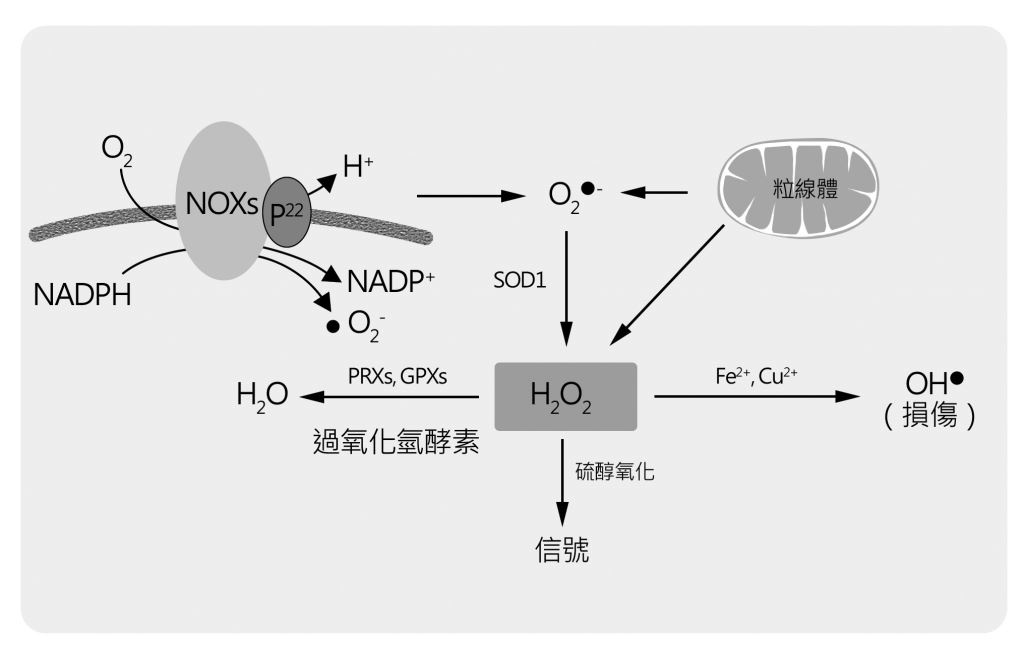
圖:粒線體內電子傳遞鏈產生的超氧自由基會被粒線體內的SOD2 清除。漏到細胞質的超氧自由基則被細胞質中的SOD1 清除。
過氧化氫在細胞內有多重轉變途徑。它可以被不同的酵素清除;它也可能碰到亞鐵或銅離子形成破壞力極大的羥自由基;
最後它也可以透過修飾蛋白質分子上半胱胺酸(cysteine),調控蛋白質活性而扮演細胞內訊息傳遞的角色。
在哺乳類動物體內有三個SOD基因,製造出的蛋白酵素分別結合不同的金屬離子,同時也分佈在細胞內不同的位置。SOD2利用錳離子(Mn2+)作輔酶,只存在粒線體中。SOD1和3都用銅和鋅離子(Cu2+ / Zn2+)作輔酶,但SOD1只存在於細胞質中,而SOD3則分泌到細胞外。如果把老鼠的SOD2基因破壞,老鼠才出生就很快死亡,表示它在老鼠發育早期扮演重要的角色。把老鼠的SOD1或3的基因破壞,老鼠活的好好的並無異狀,但SOD2基因破壞的老鼠壽命會稍短,如果SOD2和3兩個基因同時被破壞,老鼠壽命不會更短。這個結果告訴我們,細胞質中的SOD2可能與老化有一點關係,而細胞外的SOD3和老化就全然無關了!
老鼠壽命長達三年,身體結構又非常複雜,SOD2與壽命長短的關係不容易釐清。因此這個全身僅有959個體細胞,壽命不到三星期的線蟲就成了一個研究老化非常好的模式動物。2010年加州大學舊金山分校的肯揚(Cynthia Kenyon)教授首先報告一個令人迷惑的結果。她發現讓線蟲生長在缺氧的狀態下壽命會延長,這個結果乍看之下非常合理:缺氧會使粒線體中電子傳遞鏈變慢,ROS產生較少,壽命自然延長!但進一步研究發現,線蟲在缺氧的狀態下ROS不僅沒有減少,反而還會增加,增加的ROS會刺激一個轉錄因子HIP-1。HIP-1再啟動許多讓細胞存活的基因,使得壽命延長!所以ROS在這裡反而是線蟲壽命延長的「功臣」。
另外一個想法是,如果把線蟲體內清除自由基的SOD基因破壞,自由基的濃度是否增加?線蟲的壽命是否就會縮短?不同於老鼠,線蟲擁有5個SOD 基因製造不同的SOD酵素,分別負責清除細胞內不同區域的過氧化物。2008年英國科學家發現各別破壞單一的SOD基因,並不影響線蟲的壽命。但這個結果不能排除5個SOD基因之間有功能互補的可能性。因此加拿大的科學家決定一口氣把線蟲5個SOD基因全部破壞,結果發現線蟲的壽命仍舊全然不受影響。該結果發表在2012年4月10號的《美國國家科學院會誌》。……【更多內容請閱讀科學月刊第524期】