- 科技報導
文章專區
2021-10-19高端疫苗安全有效嗎?蛋白質疫苗原理與臺灣COVID-19疫苗EUA審查標準
478 期
Author 作者
蔣維倫/泛科學PanSci專欄作家、故事專欄作家、udn鳴人堂專欄作家、前國衛院衛生福利政策研究學者。喜歡虎斑、橘子、白底虎斑和三花貓
COVID-19世紀瘟疫蔓延之下,其疫苗成了各國生技傾力研發的焦點。美、英等國僅花了一年,率先開發出輝瑞、AZ等疫苗。而臺灣方面,初期有國光、聯亞、高端三家競逐,國光於一期試驗後落馬,2021年春,另兩家疫苗先後進入二期試驗。
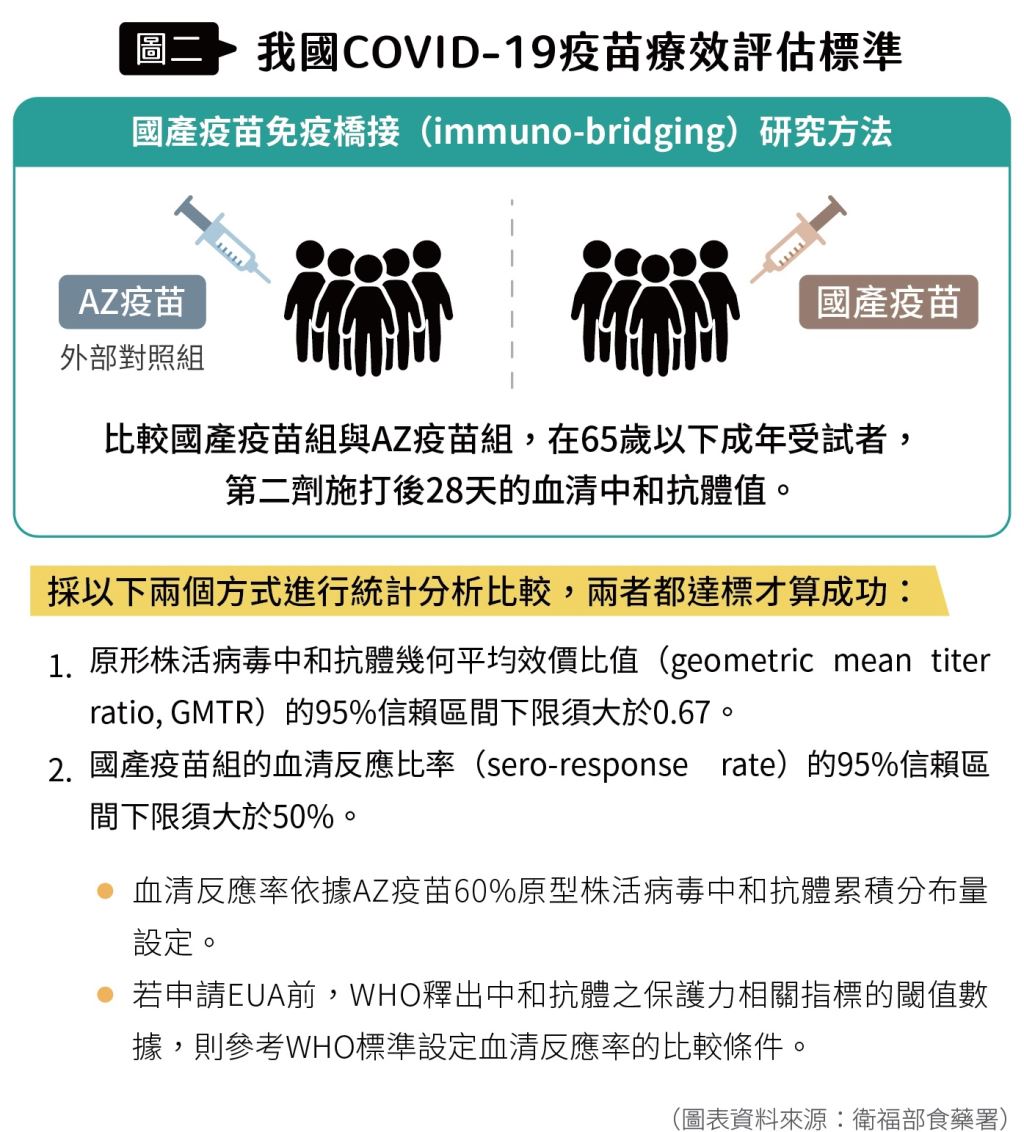
食品藥物管理署( 以下簡稱食藥署)於2021年6月10日公布國產COVID-19疫苗緊急使用授權(emergency use authorization,EUA)審查標準,相較於歐美通常以三期試驗的實際保護力為EUA審查門檻,臺灣以疫苗誘導的中和抗體效價比較為審查標準。同日,高端召開記者會公布二期實驗數據,並準備提交EUA申請。
爾後食藥署於7月19日宣布高端COVID-19疫苗通過EUA審查(圖一、圖二),成為全球首支以中和抗體效價為準、獲得緊急使用授權的COVID-19疫苗。
本文透過公開論文和政府新聞稿,從高端疫苗的原理出發,並解讀臨床一與二期的數據,簡要地介紹高端疫苗的優勢和挑戰。
高端疫苗,裡頭裝什麼?
有別於領先的歐美疫苗如莫德納疫苗、AZ疫苗皆採取較為新興的疫苗研發技術。高端選用了傳統技術──蛋白質類型疫苗。該類型平台的關鍵是「抗原」和「佐劑」的選擇。好的抗原可誘發正確的抗體,而優秀的佐劑不僅能提高抗體濃度,更可活化正確的T細胞、避免疫苗的副作用。
抗原:自SARS以來,人類就盯上了冠狀病毒
很久很久以前,歷經2002年、2012年兩波新興冠狀病毒(SARS、MERS)的震撼後,科學家就對冠狀病毒提高了警覺,開始對它們展開長期基礎研究,而其中一項重點就是「如果出現了全新的冠狀病毒,要怎麼做疫苗」。
美國在2016年就發現, 針對冠狀病毒家族開發疫苗,那麼最佳的抗原,將是融合前的棘蛋白(prefusion conformation of spike protein)。因為它不僅能誘發高濃度的抗體,而且棘蛋白就是病毒侵犯細胞的鑰匙。只要能激發出針對棘蛋白的中和抗體、堵住病毒的鑰匙,就能中斷感染、保護細胞。科學家也發現棘蛋白會自然形變、分解,因此向未來的人類提出建議,透過微調胺基酸、固定棘蛋白結構,以達到有效誘發抗體的目的。
原以為是給未來人類的研究,不知道有沒有用。沒想到只過了幾年,就真的用上了!
2019年冬天,新型冠狀病毒猶似死神突然襲來。然而,人類的反擊早在瘟疫爆發之初就開始了。各大藥廠,如:輝瑞、莫德納和高端疫苗,皆遵循著過去的建議,選用棘蛋白為抗原,並微調胺基酸、固定其結構。
以高端疫苗而言,它是和美國國家過敏和傳染病研究所(National Institute of Allergy and Infectious Diseases, NIAID)合作的成果。由美國提供已鑲入棘蛋白基因的DNA質體,高端再轉殖入倉鼠卵巢細胞(ExpiCHO-S),讓細胞大量分泌棘蛋白、純化,而後製為疫苗(圖三)。
打了蛋白質疫苗後,身體會發生什麼事?
理論上來說,當高端疫苗注入肌肉後,棘蛋白會被抗原呈現細胞(antigen-presenting cell, APC)如樹突細胞、巨噬細胞等,或B細胞吞噬。
抗原呈現細胞的職責,近似傳令兵,最大的功能是活化T細胞。抗原呈現細胞吞噬外敵後,會將其撕成碎片,再將殘肢透過主要組織相容性複合物(major histocompatibility complex, MHC)展示給T細胞們。被活化的T細胞可分為兩類,分別是:
‧輔助T細胞(helper T cell):
功能近似總司令、對免疫系統下達整體戰的指示。它可刺激B細胞複製、分泌更多抗體,也能活化巨噬細胞、強化它吞噬病原體的能力等。能演化為記憶型細胞(CD4+ memory T cell),長期地保護人體。
‧殺手T細胞(killer T cell):
可辨認、殺死被病毒感染的殭屍細胞,專職清掃戰場、防止被感染的組織進一步惡化。雖不能防止感染,但可能是遏止重症的關鍵之一。能演化為記憶型細胞(CD8+ memory T cell),長期地保護人體。
而棘蛋白除了被抗原呈現細胞吞噬、藉此活化T細胞以外,也能直接和B細胞反應(圖四)。B細胞能直接辨識天然的病毒蛋白,其受器(B-cell receptor)可以直接和抗原交互作用。而因為B細胞的抗原決定位(antigenic epitope)也就是抗原活化、刺激B細胞分泌對應抗體的位置,很大一部分取決於抗原立體結構。
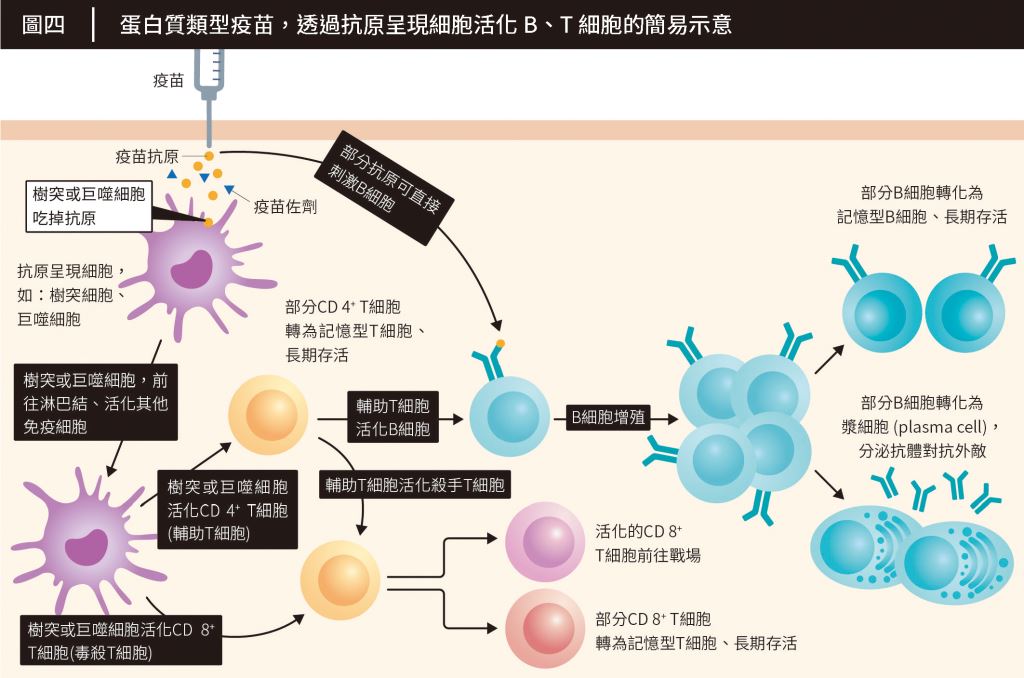
換言之,若想誘導高濃度的中和抗體,疫苗的抗原應盡可能地保持天然的3D立體結構,以配合B細胞的特性、刺激生產出可辨認病毒蛋白質立體結構的抗體。而高端疫苗的抗原,是完整的棘蛋白,理論上,也代表著該疫苗具備誘導高效中和抗體的潛力。
佐劑:提高疫苗效果,活化免疫反應
而除了前面介紹抗原的重要性,蛋白質疫苗的另一關鍵在於「佐劑」。高端疫苗混用了兩種已上市使用的佐劑,分別為鋁鹽和CpG1080。鋁鹽為金屬鋁的化合物,人類使用經驗將近100年。CpG1080則是短的雙股DNA,結構仿似細菌的遺傳物質,曾使用在美國的商用B型肝炎疫苗中。
佐劑的目的有兩個:
1. 仿造病原體入侵組織受傷害的訊號:誘使更多的抗原呈現細胞抵達現場、吞噬抗原,進而活化更多的B細胞與T細胞。
2. 觸發抗原呈現細胞:此處的重點是要使抗原呈現細胞分泌適當的細胞因子,藉此活化正確的T細胞路徑。除了輔助、殺手T細胞外,T細胞還分成TH1、TH2、TH17、Tfhs等路徑。舉例來說,若過度活化TH2路徑,將可能引起肺臟過度發炎,反而導致疾病惡化的致命反應。因此佐劑需觸發理想的T細胞路徑,避免疫苗副作用。
抗原呈現細胞會在體內四處探索,當它們遇到「疑似外敵入侵」的分子或結構,如雙股RNA等,就會呼喚、號召更多免疫細胞到達現場。高端疫苗內含的鋁鹽,能損傷部分組織細胞,釋放尿酸(uric acid),偽造人體被外敵破壞的信號;而CpG具有細菌DNA的結構特徵,能欺騙抗原呈現細胞、誤信細菌大舉入侵。高端疫苗的設計冀望透過佐劑安全地提高疫苗效果,並能活化後續的T細胞與B細胞,達到長期保護的目的。
高端疫苗的設計,有達到目的嗎?
理論再漂亮,也是要看數據說話。綜合臨床一期、二期的公開數據,科學家對高端疫苗有哪些了解了呢?
高端疫苗安全嗎?
蛋白質類型疫苗的最大優勢,就是不良反應低、安全性高。mRNA、腺病毒、DNA等疫苗技術,都會侵犯細胞來分泌抗原、有如真實的病毒感染,因此身體不適感有機會較嚴重。而蛋白質疫苗無須劫持細胞,因此學理上而言,安全性的風險和副作用都會較低。縱觀高端疫苗二期試驗的不良反應數據,亦可看出
‧高端疫苗的不良反應和安慰劑組相近
‧第一劑的不適感稍多
‧中壯年的不適感較年長者更明顯
接種高端疫苗的不適感,對大多數人來說和施打食鹽水差不多,此處可說是發揮了蛋白質疫苗的絕對優勢(圖五)。
那和歐美的mRNA、腺病毒疫苗相比呢?參考臺灣疾管署的統計資料顯示,相較輝瑞、AZ等疫苗,接種高端疫苗後的頭痛、發燒等症狀更少(圖六)。
高端有產生高效、高濃度的抗體嗎?
由前述的結果觀之,高端疫苗的副作用較少,如能在保護力上證明價值,將可望和臺灣現有來自歐美的疫苗比肩、甚至更優秀。而從二期試驗報告的血清轉化率(seroconvertion rate)來作初步判斷,可發現到20∼64歲的族群,約有99.9%產生抗體,而65歲以上受試者,也高達99.5%產生抗體。換言之,幾乎接種高端疫苗的人,都能對疫苗產生反應、誘發出抗體。
而中和抗體效價(Wi l d Type SARS-CoV-2 Neutralizing Antibody Geometric Mean Titres)數據顯示,20∼64歲族群可達732.9;65歲以上族群較低,約484.5。但由於尚未有研究公開呈現高端和其他疫苗的抗體比較,因此無法得知此數據的意義。
就現階段的數據而言(圖七),可以合理推測出:
1. 血清轉化率表示,幾乎所有施打高端疫苗的人都會產生抗體。
2. 接種疫苗後,體內中和抗體有明顯的提升。
3. 年長者抗體效價較低,若有第三劑之規劃,年長者應優先施打。
圖七:接種前和第2劑後28天,疫苗和安慰劑組之中和抗體效價變化
(針對SARS-CoV-2原始株)。
(圖表資料來源:高端疫苗二期試驗論文)
有活化到正確的T細胞嗎?
除了抗體外,疫苗開發還須回答跟T細胞有關的兩個問題。
1.T細胞是否有被活化?
若疫苗能夠有效活化輔助T細胞,即可協助B細胞轉化為記憶型B細胞(memory B cell),進而使身體在多年後,仍可對保有快速反擊的防禦力。而若疫苗能夠有效活化殺手T細胞,也能轉化為記憶型T細胞(memoty CD8+ T cell),進而在長遠的未來,若被病毒入侵後,還能避免重症等風險等。
2.活化到那種T細胞路徑?
這問題對呼吸道疾病疫苗的開發,是個痛心的教訓。1965年,第一款去活化的呼吸道融合病毒(respiratory syncytial virus, RSV)疫苗進入臨床,但卻發現受試者在自然感染野生的病毒後,疫苗不僅沒有保護受試者、反倒惡化了病症,導致20名被感染的幼兒中,竟有16人重症、最終2人死亡(安慰劑組中,21名被自然感染者,僅有1名重症)。30多年後才發現,當年的疫苗透過TH2活化了T細胞,而TH2路徑後續會活化嗜酸性球(eosinocyte)、增加IgE等,在肺部引起類似過敏反應的發炎,反而惡化呼吸道疾病。因此在開發呼吸道疾病疫苗時,藥廠都會設計提高TH1、降低TH2的活化路徑。
而針對這兩個問題,高端疫苗在1期臨床試驗數據顯示,疫苗能活化輔助T細胞,並且主要透過TH1路徑、較少透過TH2路徑,因此可暫時推測,高端疫苗應不至於重踏當年呼吸道融合病毒疫苗的錯誤,而有機會誘發記憶型B細胞、提升長期保護力(當然,仍須仰賴三期試驗才能完全確認)。
高端疫苗,真的可以用嗎?
這問題很難回答。面對COVID-19,人類了解的實在太少。但現階段考量到疫情緊迫,歐美疫苗抵台困難,本土疫苗難以短期內獲得三期試驗成果的現實下,目前食藥署通過國產疫苗之採用,主要基於下述假設:
‧3000人的安全性數據,足以推動全民接種。
‧以中和抗體效價作為免疫橋接(immuno bridging study),足以一定程度代表疫苗的保護力。
‧AZ疫苗的保護力以中和抗體效價判斷,具有一定之代表性。
食藥署六月公布的EUA審查標準,要求包含3000人以上的安全性數據,並且疫苗的中和抗體平均效價之95%信心區間之下限,不可低於AZ疫苗的0.67倍。
而最終對於高端疫苗的審查結果,認為安全性無重大疑慮,且中和抗體效價95%信心區間之下限,為AZ疫苗的3.4倍,遠高於AZ疫苗,符合標準(圖八)。因此高端疫苗成為國內,也是全球第一個透過免疫橋接的方式,取得國家許可的COVID-19疫苗。
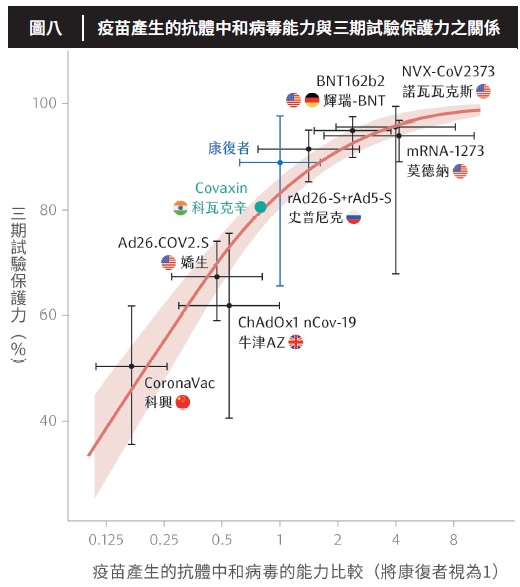
疫苗在一或二期臨床試驗中,產生之抗體對於中和原始株病毒的強度(設康復者血清抗體強度為1),和其疫苗在三期試驗中表現之保護力的比較。
僅管食藥署對國產疫苗的審查標準,是在現實和理想中取捨的決定,在此階段很難評斷政府是「洞燭機先」,亦或「一著不慎,滿盤皆輸」?但值得提醒大家的是,高端疫苗尚缺乏在疫區歷練的三期臨床試驗,也就無法得知實際面臨疾病時最重要「對抗重症」與「避免死亡」的數據,此點仍然相當令人擔憂。7月20日,高端疫苗宣布將前往巴拉圭進行三期試驗,儘管該試驗仍非傳統、大型的試驗設計(收案1,000人、對照組為AZ疫苗、採用免疫橋接進行比較),但由於巴拉圭疫情較臺灣嚴重(八月下旬,每日新增感染數的7日平均值約100例),也許將有機會揭露高端疫苗對抗重症和死亡的能力。
儘管希望本土疫苗能成功、讓臺灣揚眉吐氣,但仍希望國產疫苗透過友邦的研究,協助世界更了解疫苗的真實面貌。在疫苗已惡化為政治問題的今日,希望以三十多年前費曼在挑戰者號太空梭爆炸的報告裡所述:「成功的科技,需要依據事實而非公關,畢竟,大自然是無法愚弄的」共勉之。
保持冷靜,繼續前進。Keep Calm and Carry On.
延伸閱讀
1. Andrew J. Pollard & Else M. Bijker, A guide to vaccinology: from basic principles to new developments, Nature Reviews Immunology,2021.
2. Hsieh Szu-Min et al., Safety and Immunogenicity of CpG 1018 and Aluminium Hydroxide-Adjuvanted SARS-CoV-2 S-2P Protein VaccineMVC-COV1901: A Large-Scale Double-Blind, Randomised, Placebo-Controlled Phase 2 Trial, MedRxiv, 2021.
3. Szu-Min Hsieh et al., Safety and immunogenicity of a Recombinant Stabilized Prefusion SARSCoV-2 Spike Protein Vaccine (MVCCOV1901) Adjuvanted with CpG 1018 and Aluminum Hydroxide in healthy adults: A Phase 1,doseescalation study, EClinicalMedicine, 2021.