- 專欄
文章專區
2014-01-01魔術般分子結構的配位化學—維爾納獲諾貝爾獎百周年
529 期
Author 作者
高憲章/任職淡江大學化學系。
科技的進步,在3C電子產品上看得最清楚,不斷的朝著輕薄短小發展,逐漸走入奈米尺度。當然,材料大小發展到一個極致,就是朝向分子等級來設計元件,也就是各種分子機械、分子元件、分子電晶體等,於是,在科幻小說中出現的各種機械將會出現在現實的生活中。在化學的種種領域中,配位化合物由於具有下列特性:易結合又易解開、多變且易於調控的分子結構、可控的氧化還原等,而成為設計這類型分子元件的最佳候選。
配位化合物的源起
自古以來,我們的老祖宗們就懂得從環境取材運用,以尖銳的石器作畫,再以碳灰、礦石等塗色,像法國拉斯科(Lascaux)的洞穴上那些栩栩如生壁畫的氧化鐵。各國繪畫的顏料,很多都是從礦石中所得來,如張大千大師親自研磨作畫的石青石綠顏料。這些都是配位化合物,人類使用配位化合物已經有非常久歷史,但是配位化合物的化學秘密,在最近這一百年才逐漸被解開。
最早有記載的配位化合物,是十八世紀初作為深藍色顏料的普魯士藍,由德國的狄斯巴赫(Heinrich Diesbach)發現的。他想要製造紅色顏料,把草木灰和牛血加熱反應,產物再與氯化鐵溶液混合,卻意外得到一種鮮豔的藍色沉澱,而且居然是種優良的藍色塗料。很久以後,化學家才知道草木灰中的碳酸鉀和牛血中含氮化合物,加熱以後形成氰化物,再與血中的鐵發生反應,得到黃色的亞鐵氰化鉀K4[Fe(CN)6],這種晶體用牛血製成,所以稱為黃血鹽,它與氯化鐵反應後,就是普魯士藍(亞鐵氰化鐵),化學式為Fe4[Fe(CN)6]3。
發現普魯士藍的合成方法後,法國科學家塔薩厄爾(B. M. Tassaert)在進行鈷化合物的實驗時,想把鈷離子用鹼沉澱出來,因為氫氧化鈉用完了,所以只好用過量氨水代替。將氨水加入氯化亞鈷水溶液中,結果發現得不到沉澱物,反而隔天析出橙黃色的晶體,分析以後得知是Co(Cl3)(6NH3),又發現鈷離子可以和氯離子、水、一氧化碳等生成類似的化合物。不過,當時的化學家們還無法解釋這些化合物的結構、特性以及鍵結性質,因此僅能就顏色的差異、導電性等特性進行觀察(表一)。
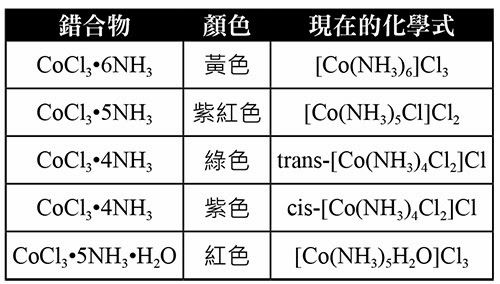 表一:各種不同結構鈷離子與其顏色
表一:各種不同結構鈷離子與其顏色
維爾納與約根森的論戰
當時在有機化學結構上的研究已經有了一定的水準,因此對於這些含金屬化合物的奇特顏色表現,化學家們很自然的就會拿有機化學所建構的理論,套用在這些化合物上。丹麥科學家約根森(Sophus Mads Jørgensen, 1837~1914)首先提出了一套理論,他認為元素只有一種價態,所以在鈷錯合物CoCl3•6NH3 中,三價的鈷離子只會形成三個鍵,為了解決多出的那六個胺,勢必要形成一個鏈狀的結構,而氯離子就可接在胺上(圖一A)。而氯離子接在胺上,距離鈷很遠,因此氯化銀可以很快的把這三個氯都沉澱出來。CoCl3•5NH3少了一個胺,因此就有一個氯離子直接與鈷離子鍵結,這個氯離子就不容易被銀沉澱(圖一B)。同理,CoCl3•4NH3 與CoCl3•3NH3 的結構也近似,並符合氯化銀沉澱的結果(圖一C)。
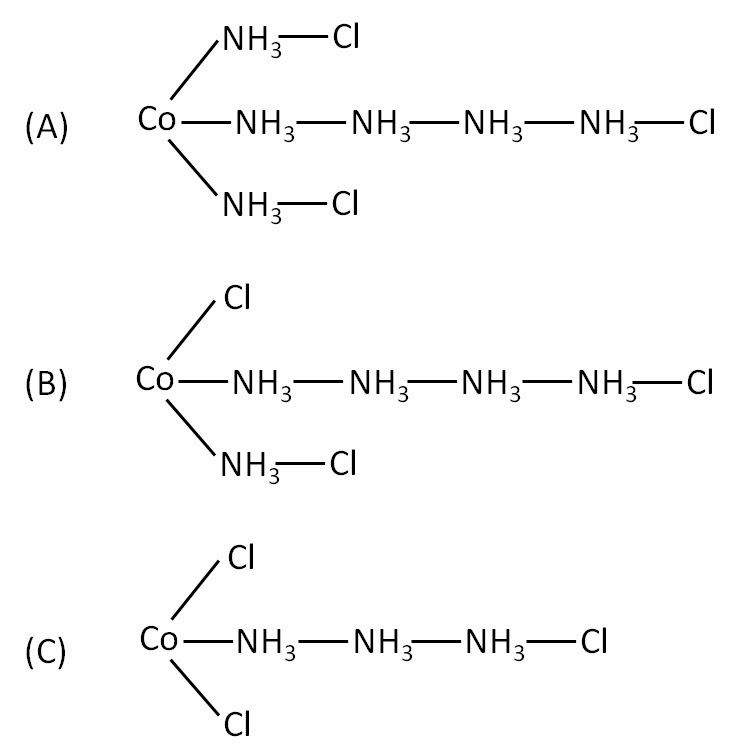 圖一:約根森所推測的鈷錯合物結構。
圖一:約根森所推測的鈷錯合物結構。
(A)CoCl3•6NH3
(B)CoCl3•5NH3
(C)CoCl3•3NH3
在1893年時,年僅26歲的瑞士化學家維爾納(Alfred Werner,1866~1919,獲1913年諾貝爾化學獎,圖二)提出了全新的配位理論、配位化合物與配位數這些非常重要的概念,建構了現代的配位化學,他的假設主要分成三點:
1. 大多元素可以擁有兩種以上的價態,稱為一級價(primary valence) 與二級價(secondary valence)〔註〕。
2. 每個元素都傾向於形成同時滿足一級價與二級價的化合物。
3. 二級價決定了化合物在空間中的結構與鍵結的位置。
圖二:瑞士化學家維爾納。
維爾納把CoCl3•6NH3 改寫成[Co(NH3) 6]Cl3,利用中括號來區分一級價與二級價,鈷的一級價(或是我們現在說的氧化態)是+3,因此有三個氯離子鍵結;二級價(配位數)則是6,六個胺填滿了這六個配位數,直接和鈷離子鍵結,我們稱這些胺配位在鈷離子上,因此這些胺稱之為配位子。氯離子是為了滿足正負電中性化合物的要求,並沒有直接的鍵結,所以只要加入銀離子溶液,這三個氯離子立刻就會被沉澱下來。至於少了一個胺的CoCl3•5NH3,為了滿足二級價(配位數)為6,一個氯必須直接與鈷鍵結,因此應寫成[Co(NH3)5Cl]Cl2。CoCl3•3NH3 應寫成[Co(NH3)3Cl3],三個氯離子都與鈷形成配位鍵,因此加入銀離子也不會有氯化銀的沉澱。為了證實自己的假設是正確的,維爾納花了大量的時間,將每一個鈷的胺鹽通通合成出來,也以其他類似價數的錯合物進行比對,結果他發現,只要是具有[MIII(NH3)3Cl3] 的錯合物(M 為金屬),溶解以後不會形成離子對,也無法用硝酸銀溶液沉澱出氯化銀,因此他對於配位化合物的假設是正確的,推翻約根森的假設。 ..........【更多內容請閱讀科學月刊第529期】