- 精選文章
文章專區
2014-03-01從單胞藻到腦神經細胞
531 期
Author 作者
李志昌/任職加拿大多倫多大學牙醫學院。
單胞藻(Chlamydomonas reinhardtii),大小約10μm (1 μm = 10-6 公尺),一種淡水中常見的單細胞藻類。兩根長長的鞭毛,讓它們可以在水中以螺旋的方式前進(圖一),遇到光刺激時,它們會改變行進的方向,其眼點具有很靈敏的感光能力,單一光子便足以引起其運動的改變。這樣的單細胞藻類與腦神經細胞之間會有什麼關係呢?
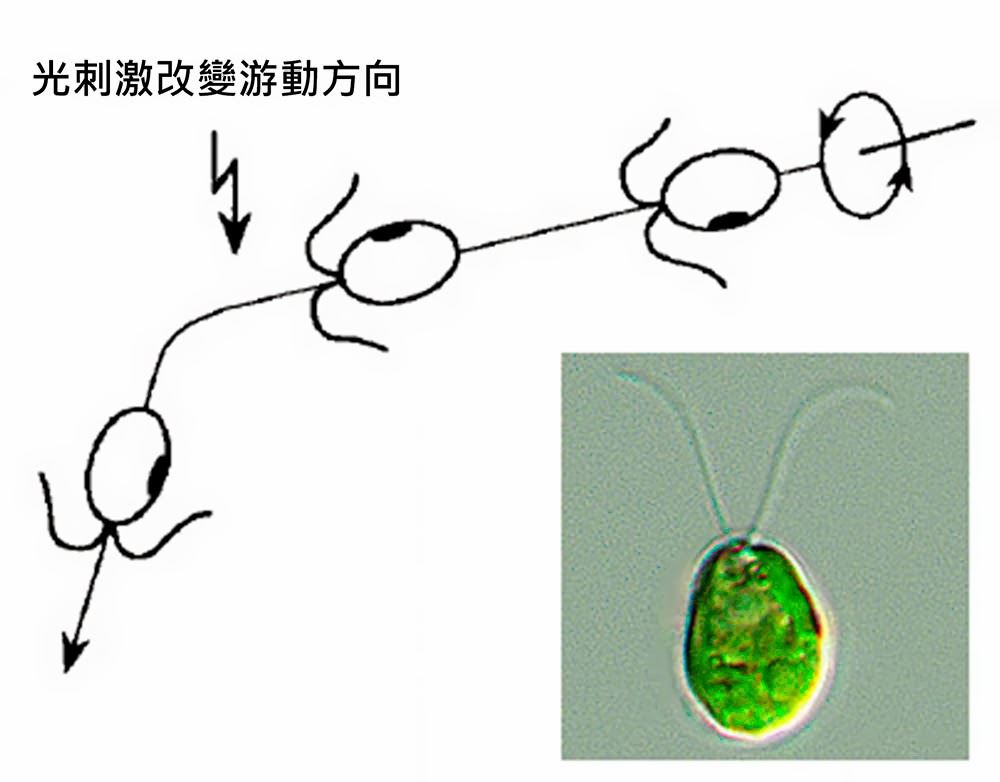 圖一:單胞藻為球狀,有兩根鞭毛,以螺旋翻滾方式游泳,光線刺激可改變其行進路徑。
圖一:單胞藻為球狀,有兩根鞭毛,以螺旋翻滾方式游泳,光線刺激可改變其行進路徑。
(作者改編自Kriiger與黑格曼論文)
單胞藻的感光與運動控制機制的研究,源於1990年左右德國的科學家黑格曼(Peter Hegemann)等人所進行的一系列實驗。而其最重大的研究成果是內格爾(George Nagel)等人在 2002與 2003年, 發表該團隊研究單胞藻所發現的兩種感光蛋白質:光敏感通道蛋白–1(Channelrhodopsin-1, ChR1)與光敏感通道蛋白–2(Channelrhodopsin-2, ChR2),以及它們的基因序列。不僅如此,他們還將這些基因植入蛙卵細胞(oocytes of Xenopus laevis)或人類胚胎腎細胞(HEK293)使其製造原本只在單胞藻才有的 ChR1或 ChR2感光蛋白質。結果在光線的刺激下,蛙卵細胞或人類胚胎腎細胞竟然可以對光線刺激起反應。光線刺激會造成ChR1與 ChR2的蛋白質結構改變形狀,將通道打開,選擇性地讓質子流(H+)通過ChR1通道,或是正離子流(Na+, K+, Ca2+)通過ChR2通道(圖二)。在這些被植入ChR1或ChR2基因而表現出感光蛋白質的細胞上,他們成功地記錄到光線刺激引起的電訊號變化。
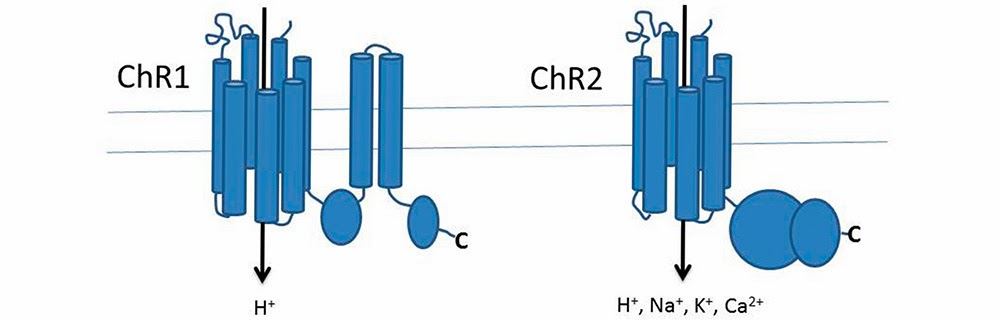
圖二:光敏感通道蛋白質ChR1與ChR2的結構圖。
兩者皆是離子通道,在光線刺激下,通道會打開,ChR1可選擇性地讓質子流(H+)通過,ChR2則是選擇性地讓正離子通過。
(作者改編自Sineshchekov論文)
2005年,在史丹福大學代塞爾羅思(Karl Deisseroth)的實驗室,博依登(Edward Boyden)等人成功地將ChR2基因植入體外培養的神經細胞(取自大白鼠海馬回),在顯微鏡下以電極記錄細胞內的電位變化。經光纖傳導的藍光鐳射照射下,神經細胞開始興奮產生動作電位,他們可以用鐳射光激發神經細胞的活動,精確度高達千分之一秒的等級(圖三)。
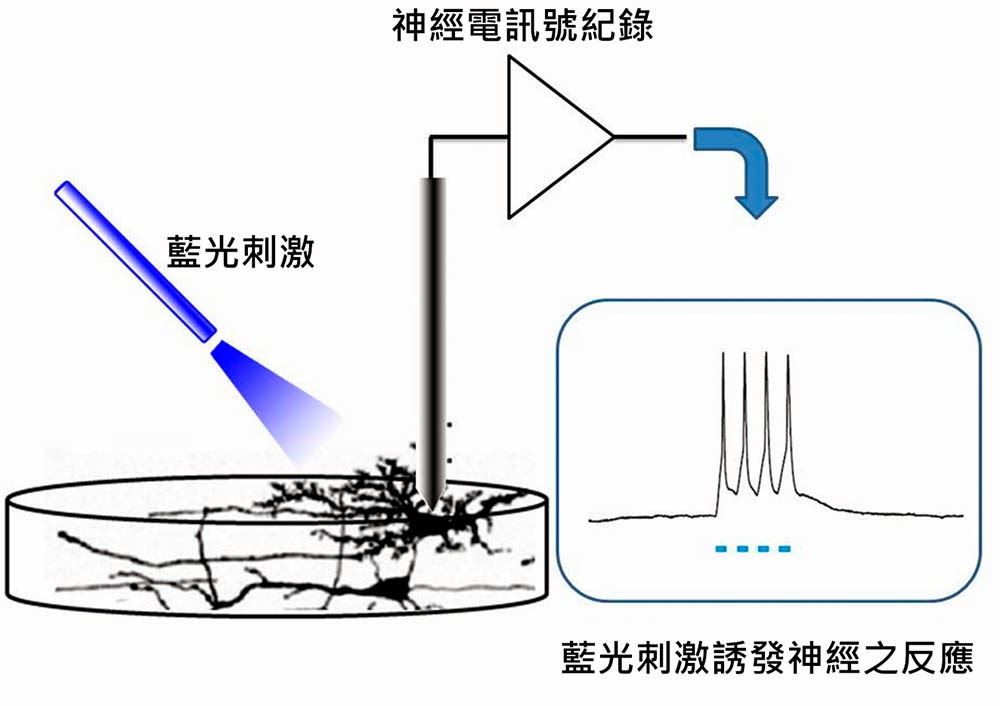
圖三:植入ChR2基因的神經細胞,在藍光鐳射下可以刺激神經,使膜電位產生去極化反應。
(作者改編自博依登論文)
2007年,這個史丹福大學的實驗室,成功培養出 ChR2的基因轉殖小鼠(ChR2 transgenic mice)。他們在小鼠的大腦皮質控制肢體運動的區域,埋設記錄電極與光纖,成功地在活體上記錄到鐳射刺激所激發的神經活動。這隻基因轉殖小鼠在藍光鐳射刺激下,大腦運動區開始放電,結果你會看到小鼠像參加百米賽跑一般,啟動雷射有如鳴槍開跑,只見小鼠開始繞圈狂奔,直到藍光鐳射關閉後才慢下腳步。
2009年,MIT媒體實驗室(MIT Media Lab, Synthetic Neurobiology Group)的韓雪(Xue Han)等人,以慢病毒(Lentivirus)當作載體,成功地將ChR2基因植入猴子的大腦皮層中,使猴子的大腦神經細胞可以生產感光的蛋白質ChR2,並能對藍光鐳射產生反應(圖四)。這個在猴子腦部完成的實驗,具有重要的指標意義,病毒載體將來自異種生物的ChR2基因,植入靈長類腦內的特定類型神經細胞後,是否會干擾原本正常神經系統的運作?是否會引起免疫反應來對抗這些原來不屬於這個系統的外來物質?這些都是關係到這個方法可否進一步應用於人體臨床上的關鍵。可喜的是這個實驗的結論,基本上證明這個方法,至少在實驗操作的幾個月觀察期中,在猴子身上是安全的。.....【更多內容請閱讀科學月刊第531期】
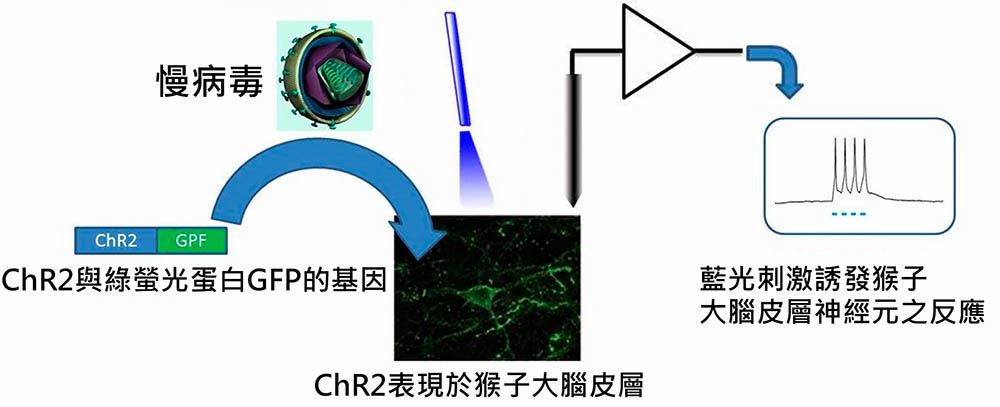 圖四:猴子大腦皮層ChR2之表現以及藍光鐳射刺激示意圖。
圖四:猴子大腦皮層ChR2之表現以及藍光鐳射刺激示意圖。
將設計好的ChR2與綠螢光蛋白GFP的基因片段,以慢病毒當作載體,將基因植入猴子的大腦皮層中。
在記錄的半年內,藍光鐳射可誘發大腦皮層神經細胞產生反應。
(作者改編自韓雪論文)