- 封面故事
- 2016年
- 564期-2016諾貝爾獎特別報導(12月號)
文章專區
2016-12-01大隅良典與細胞自噬
564 期
Author 作者
李岳倫/國家衛生研究院癌研所副研究員, 專長為癌症逆境生理研究。
「 To die or not to die:that is the autophagic question.」這是法國國家衛生研究院克勒默(Guido Kroemer)博士一篇論文的標題,意思是「死亡還是生存,是自噬的問題」。的確,生死的奧秘,一直是人們終其一生想要追求的聖杯。科學家們也不例外,嘗試從生物個體或細胞層次來找尋這個問題的答案。怎麼死?什麼時候死?看起來簡單的哲學問題,卻也是科學家們從古至今以來的大哉問!能夠回答這些問題的研究,自然也是重要發現。於是,2002 諾貝爾生理及醫學獎就頒給了揭開細胞死亡在控制器官發育的分子機制的科學家,他們是加州大學柏克萊分校的布瑞能(Sydney Brenner)博士、麻省理工學院霍維茲(Robert Horvitz)博士及英國劍橋大學薩爾斯頓(John E. Sulston)博士。依循化約論(Reductionism),既然生物個體的基本單位是細胞,那細胞是如何調控死亡?尤其是當細胞面對各種環境壓力下,如飢餓、缺氧、溫度、酸鹼,細胞為因應惡劣環境,會啟動許多適應存活機制,在「適者生存」這隻看不見的手推動下,這些機制就成為細胞存活下來的重要利器,其中一種機制就是自噬作用(autophagy)。早在1960 年代,就已觀察到細胞在面臨飢餓時,利用自噬作用取得能量與養份度過危機,但機制不明。直到1990 年代,才因日本科學家大隅良典的研究才真正了解其詳細機制,這也讓大隅教授單獨獲得2016 年的諾貝爾生醫獎。
大器晚成的大隅良典
71 歲的大隅良典教授獲獎實至名歸,但他的研究之路,並非一帆風順。就在二次大戰太平洋戰爭終戰前的1945 年2 月9 日,大隅良典出生於日本福岡,從小受到父兄的影響而啟發了對科學的興趣。1967 年從東京大學基礎科學科畢業,1974 年獲東京大學理學博士學位。修業時期師從今堀和友教授,專攻抗生素大腸菌素E3(colicin E3)抑制大腸桿菌蛋白質生合成的研究。1974~1977 年間,在恩師今堀和友的引介下,大隅良典遠渡美國,進入1972 年諾貝爾生醫獎得主洛克菲勒大學艾德曼(Gerald Maurice Edelman)的研究室,擔任博士後研究員3 年。坦白說,在美國的3年博士後研究並沒有好成績,也許是在摸索自己的研究方向,慶幸的是,與此同時找到了日後奠定他研究基礎的材料——酵母菌。返國後回到母校東京大學,按照日本大學的制度,一開始只能跟著安樂泰宏(Yasuhiro Anraku)教授做研究,也開啟了他在細胞液泡(vacuole)與囊泡(vesicle)的研究。從1977擔任研究助手開始,1986 年升任講師,1988 年轉至教養學部(College of Arts and Sciences)生物系擔任助理教授,成立自己的研究室,這年已43 歲,他曾自嘲那是個「很小的研究室,只有3 個人」。即使獨立後,他仍沒改變研究方向,還是專注、繼續蹲點在液泡的研究,就這樣再蹲了4 年, 一直到1992 年, 獨立發表了第一篇有關「細胞自噬」的論文。然後利用酵母菌陸續找到了一系列控制「細胞自噬」的基因。有自己研究主題、也有些成果後,他隨後在1996 年離開東京大學,轉至位於岡崎的國立基礎生物學研究所擔任教授,這年他51 歲。他在這完成了許多重要的發現,直到2009 年退休。然後同年轉至東京工業大學(Tokyo Institute of Technology)綜合研究院、前沿研究機構擔任特聘教授至今。因此,他曾感慨地說,若當初沒有離開東京大學,也許無法完成這些有關「細胞自噬」重要的發現。
.png) |
大隅良典(Ōsumi Yoshinori, 1945 ~)
國籍|日本
現任|東京工業大學前沿研究機構特聘教授
研究領域|細胞生物學、分子生物學
(Photo courtesy of 東京工業大學) |
細胞的生死關頭抉擇:細胞自噬的奧秘
什麼是「細胞自噬」?簡單來說,細胞自噬是細胞對於自己的胞器進行分解、回收的機制。如果將細胞比喻成小型工廠,許多不同的部門(胞器)分工合作維持工廠的最佳運作。但若大環境不佳或員工壓力太大,就可能造成各生產線中出現了不良產品,這時該怎麼辦呢?沒錯!就需要有回收或銷毀系統。所以細胞內可藉由許多微小的「垃圾回收車(囊泡)」來清理異常的胞器、老舊的蛋白質或入侵的微生物等,接著將垃圾載往「垃圾處理場(溶酶體,lysosome)」,整個過程稱為「自噬作用」。此英文單字也說明一切,Autophagy 來自於希臘文的「自我(self)」和「吃(eat)」兩字的結合,因此也可以說 Autophagy 就是「自食」的過程。還有一個中文字更傳神,自食就是食我、就是「餓」,而自噬作用就常發生於細胞很「餓」的時候。那細胞為什麼非得要自己吃自己呢?其實這過程對於細胞的生存是一個關鍵的機制。
回頭來談細胞死亡與自噬作用的關係,細胞可以分成壞死跟好死。細胞死於非命,就叫壞死(necrosis);和緩而有計畫性的死亡,就是好死,細胞生物學家給了這種死法一個很典雅的名稱,叫做凋亡(apoptosis),就是凋零而亡的意思。該字源自希臘文,用來形容樹葉或花的自然凋落的過程,而2002 諾貝爾生醫獎就是頒給了揭開細胞凋亡的分子機制。每個細胞都有其壽命,也有其階段性任務,當他們完成任務時,這些細胞會開啟一連串的程式性死亡,透過關閉能量工廠粒線體,這種死亡對於鄰近細胞不但沒有不良影響,而且可分解成基礎原料供給鄰近細胞回收利用。當細胞在面臨環境壓力時,常需要做出生死關頭的抉擇,那此時細胞又是如何調控死亡?原來,在細胞內會發現某些胞器(如粒線體)用類似細胞膜的結構包裹起來,然後與溶酶體融合來溶解掉這些可用的胞器取得能量與養份度過危機。而細胞自噬與細胞凋亡最大的差別,在於自噬只要度過危機,不見得會死亡;當然,在某些情況下,細胞自噬也會誘導細胞凋亡或者啟動自噬式的細胞死亡(autophagic cell death)。
其實,「細胞自噬」現象早在1960 年代就已經有科學家觀察到了。比利時科學家杜夫(Christian de Duve),因發現溶酶體(lysosome) 獲頒1974 年諾貝爾生醫獎。當時,他就懷疑那些要被送到溶酶體內分解的胞器,勢必經過一些運送過程,因此推論應有傳遞大型胞器到溶酶體內的機制。他發現,當細胞接受到營養或氧氣不足等訊息時,細胞內的蛋白質和脂質會形成彎月狀的雙層膜構造,稱為吞噬泡(phagophore)。吞噬泡會不斷增加新的膜,不斷長大將受損胞器或蛋白質包圍,最後形成囊泡,於是杜夫將這些囊泡命名為自噬小體(autophagosome),也將這個過程命名為細胞自噬,但是對其詳細分子機制卻仍是丈二金剛摸不著頭緒。大隅教授在1988 年開始經營自己實驗室後,仍專注在研究酵母菌中負責降解蛋白質的液泡,相當於人體中的溶酶體。當時學界已知人類細胞自噬作用,只是分子機制未知。研究液泡的大隅教授自然知曉自噬作用,於是,他決定用酵母菌來幫助他研究細胞自噬的過程。不過他卻發現酵母菌太小了,小到連其內部構造都不易在顯微鏡下觀察,所以根本無法確定在酵母菌中真的有自噬作用。他想,如果不能直接觀察,那麼有沒有其他方法能間接證明酵母菌細胞中真的有此機制?於是,他先培養了一群缺乏液泡蛋白分解酵素的突變型酵母菌,如果能阻止分解過程,也許當細胞自噬被啟動時,自噬小體便會持續累積在液泡內,便可利用顯微鏡來觀察。然後他利用飢餓來引發細胞自噬的產生,果不其然,液泡在幾個小時內充滿了沒有被降解的自噬小體。這個實驗,成功證明了酵母菌的確存在著細胞自噬,更重要的是,他現在擁有可以分析並找出細胞自噬關鍵基因的系統模型生物,於是,他在1992 年發表了這個重大的突破。
隨後,他以能隨機引發基因突變的化合物處理酵母菌細胞。按照他的假設,一旦參與自噬作用的重要基因被破壞,自噬小體便不會有累積的現象。僅僅經過1 年的研究之後,不但成功找到第一個自噬作用中關鍵的基因,當時命名為APG1,更一口氣找到了15 個自噬作用重要的基因,命名為APG1-15,這些基因隨後在2003 年統一命名為ATG。由於大隅良典在自噬作用領域開創性的研究,「細胞自噬」從2000年來受到科學界的重視,也發現了許多不同形式的細胞自噬。比方說「細胞自噬」依照分解對象的專一性,可分成非選擇性與選擇性。非選擇性「細胞自噬」常發生在面臨環境壓力時; 而選擇性「細胞自噬」常常負責細胞內控管品質的機制,比如當細胞碰到蛋白質損壞聚集、微生物入侵、粒線體損壞等危機時, 就必須藉由特定接受器辨認清除。如損壞粒線體的清除,就是粒線體自(mitophagy), 可透過自噬作用接受器自噬受體p62(autophagy receptor p62),與粒線體上的接受器帕金蛋白(parkin protein) 結合, 負責回收受損的粒線體。另外,除了傳統的細胞自噬可分解回收胞器稱巨型細胞自噬(macroautophagy)外,還有微型細胞自噬(microautophagy)及需要伴護蛋白(chaperone)來辨認送到溶酶體的伴護蛋白媒介細胞自噬(chaperonemediated autophagy)等。
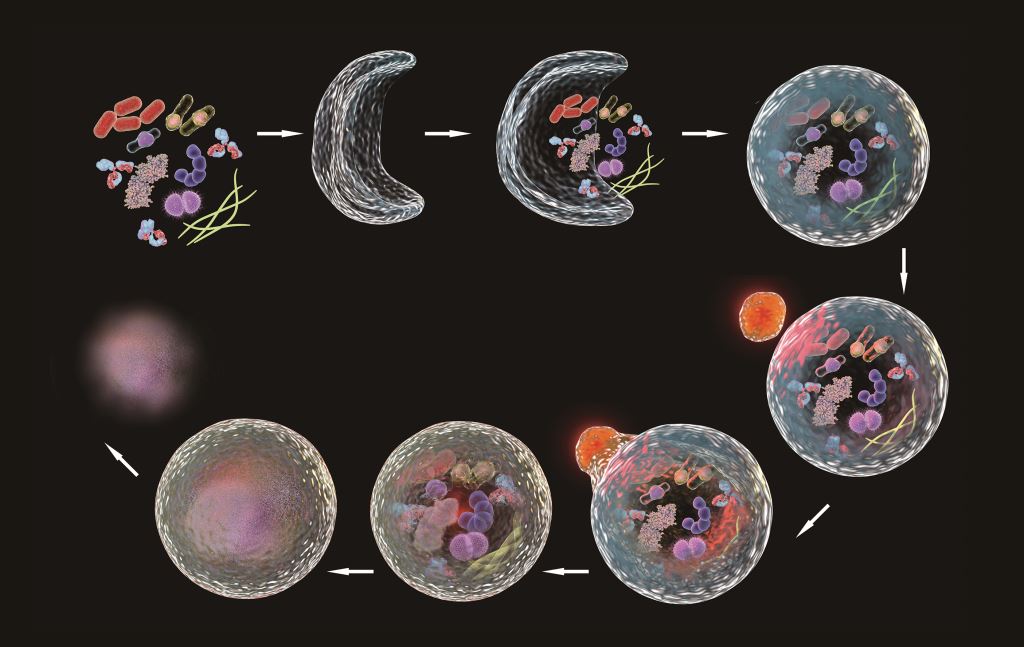
圖一:當細胞中聚集了許多異常或老舊的胞器,此時多種蛋白質和脂質先形成彎月狀的雙層膜構造,稱為囊泡,膜會逐漸增大,並且將受損的胞器或蛋白質包圍,最後成為囊狀構造的自噬小體,並與溶酶體融合形成自噬溶小體(autolysosome),藉由溶體內水解酵素進行降解,稱為自噬作用。(shutterstock)
了解細胞自噬將有助疾病治療
起初,細胞自噬被發現是細胞面對各種環境壓力時的一種適應存活反應。不過,在大隅良典從1990 年代的開創性研究後,慢慢知道細胞自噬扮演細胞內蛋白質與胞器的恆定及品質的管控,包括長半衰期的蛋白質以及粒線體、過氧化體(peroxisome)、內質網等胞器。因此,倘若細胞自噬的基因突變,可能影響有害的蛋白質和胞器的清除、細胞分化與胚胎發育過程、入侵的細菌或病毒的清除,而導致老化、癌症、神經系統退化疾病、第二型糖尿病及感染發炎反應等疾病。以失智症、帕金森氏症等神經退化性疾病為例,起因都是因為蛋白質不正常摺疊、堆積所致,而細胞自噬就像是清道夫一般,可以清除不正常結構的蛋白質。所以只要了解啟動細胞自噬的機制,就可能找到這些疾病的有效療法。
以下舉癌症為例來進一步說明。現在「細胞自噬」已作為開發癌症藥物的標的。因為當以抗癌藥物或放射治療時,會誘發癌細胞自噬作用的產生,做為維持存活的機制,而造成抗藥性,常限制了癌症治療的效果。若能抑制細胞自噬,對抗癌可能會有幫助,如傳統上用於治療瘧疾與自體免疫疾病的奎寧(quinine)(圖二)就是細胞自噬的抑制劑。臨床上已將奎寧和常用的化療、標靶藥物結合,也有不錯的效果。當然,「細胞自噬」對癌症治療的角色並非如此單純簡單,別忘了「細胞自噬」也能誘發細胞死亡或凋亡。現階段對於如何調節「細胞自噬」來控制癌細胞的存活或死亡,所知還是相當有限。而保護細胞還是處死細胞的雙面刃角色,可能與細胞的形態、癌細胞微環境、刺激的種類與強度有關係。
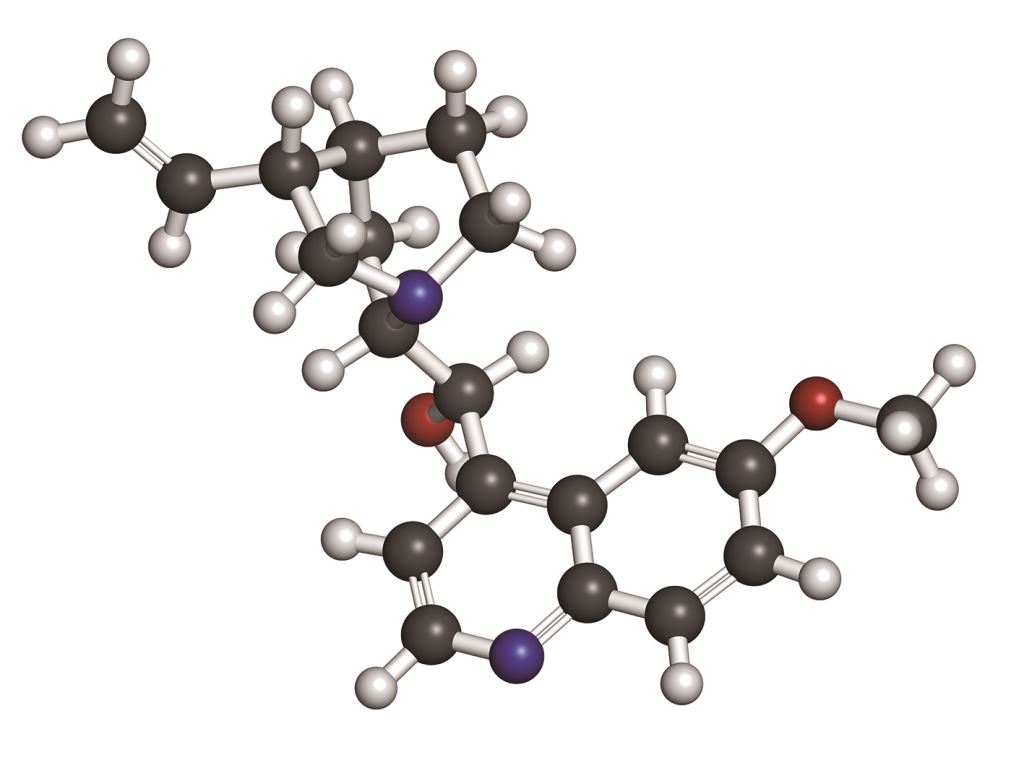
圖二:奎寧,分子式C20H24N2O2,從金雞納(cinchona)樹皮中萃取。氫(白色)、碳(灰色)、氧(紅色)、氮(藍色)。(shutterstock)
結語與啟示
2016 的10 月,諾貝爾獎委員會宣布將生醫獎頒發給71 歲的日本科學家大隅良典,官方新聞稿中表彰他對在細胞內的回收以及存活機制扮演重要角色的「細胞自噬」之開創性研究。他的研究開啟細胞壓力生理反應之另一種思維以及在人體基本生理機制中扮演的重要角色,也直接影響了對人類疾病的理解與治療,包括癌症、老化、神經系統退化疾病、免疫反應。然而,當諾貝爾獎的10 月熱過去後,不管是湊熱鬧或羨慕之餘,還有什麼是值得我們參考學習?
大隅良典是第25 位日本人榮獲諾貝爾獎的得主,也是在生醫獎領域的第4位日本得主,更是繼去年大村智之後連續3 年日本人榮獲諾貝爾獎。一字攤開這些日本得獎者,絕大多數的得獎者的工作都是在日本本土扎根數十年之久取得,在數量上僅次於美國。這正是日本學者的特色:謹慎、忍耐、堅持,這也許跟他們的學術制度有關。首先,日本大學的教授不多,能夠成為教授的,多是圈內真正的大牌教授,在研究經費和條件上佔有先天優勢,通常年輕學者都會先選擇跟著他們做研究;再者,教授大都不會太限制副手們的研究細節,這些副手們也大多是自己獨立帶團隊研究;再加上日本傳統的長幼尊卑、一絲不苟的傳統民族性,讓學者願意默默蹲點,最後尋求在自己的領域發光發熱。但在這種制度下,想要出人頭地,若不想等教授退休,就是轉到其他大學擔任教授一途,那麼就只有一個條件:必須做出優秀成果。正所謂「適度壓力,使人成長」就是此義。
另外,大隅教授在受訪時表示,他很高興可讓年輕人知道像他這樣的基礎研究者也能幸運獲獎。他也認為,要求科學研究應當「有用」,形同宣判基礎科學死刑。因為「有用」這個詞正在戕害社會,基礎科學真正「有用」可能是10 年後、或是100 年以後。如此語重心長,可能也因看到現今日本社會不再重視基礎科學研究,現在年輕學者有追求眼前成果的傾向,甚至為了有用的名利,鋌而走險,從事舞弊行為,如最近之小保方晴子事件。他以自己為例,當初開始做細胞自噬研究時,並不知這研究與癌症或神經退化疾病有何關係,而是自己的興趣驅使了這基礎研究的開始。因他覺得,去發現沒人做的事,其實是很快樂的。當被問到未來方向時,他說,科學是無法預測的,只能等待疑問陸續湧現,不過未來還是會用酵母菌探求很多解答,希望能定量分析到底細胞自噬對代謝有何影響。相信這次日本的基礎
究再次獲獎,是給日本科學界重新肯定與鼓舞。
科學本來就無法準確預估前景的,或許基礎科學無法立竿見影,甚至立了竿,還見不到影。但是,只要撒下基礎科學的種子,默默耕耘,最後可能不只是開花結果,說不定哪天開花過程中也能招來蜜蜂釀成蜂蜜呢!期待臺灣社會也能放眼未來,將基礎科學研究視為一種「文化」,而不是只有「產業」。