- 科技報導
- 生醫先鋒
文章專區
2024-12-16除了傳染病,疫苗還能預防或治療癌症? 癌症疫苗的最新進展
516 期
Author 作者
陳淵銓/仁德醫護管理專科學校助理教授
疫苗是由微生物體或它的抗原決定因子(antigenic determinant)製成的生物製劑,可誘發對抗微生物感染的後天免疫反應。疫苗接種是保護未受感染者、減少中重度症狀甚至死亡,以及降低感染性疾病傳播速度和範圍的策略之一。近年來新型生物技術的發展,包括新型傳遞工具、佐劑(adjuvant)及mRNA抗原的開發,使疫苗大放異彩。從傳統的只能用於預防感染性疾病,逐漸延伸至非感染性疾病,並擴展到能治療疾病,特別是在預防和治療癌症領域已有顯著進展。
癌症多年來一直名列世界各國死因前茅,令人聞之色變。致癌的因素很多,可粗分為環境因素(例如抽菸、酗酒、不當飲食、空氣汙染等)、物理因素(例如輻射、放射性物質、紫外線等)、化學因素(例如農藥、黃麴毒、亞硝酸鹽等)、生物因素(例如病毒、細菌、寄生蟲等)。其中,特定微生物感染導致全球約16∼18%癌症,像是引起胃癌的幽門螺旋桿菌(Helicobacter pylori),引起肝癌的B型肝炎病毒(Hepatitis B virus, HBV)、C型肝炎病毒(Hepatitis C virus, HCV),引起子宮頸癌的人類乳突瘤病毒(Human papillomavirus, HPV),引起鼻咽癌的第四型人類疱疹病毒(Epstein-Barr virus, EBV),引起血癌的人類T淋巴細胞病毒第1型 (Human T-Lymphotropic Virus-1, HTLV -1) ,以及引起卡波西氏肉瘤(Kaposi's sarcoma)的人類疱疹病毒第8型(Human Herpesvirus-8, HHV-8)等。
傳統上,疫苗通常用於預防微生物引起的感染性疾病,無法預防非感染性疾病,例如神經退化性疾病、代謝性疾病、心血管疾病和癌症等。然而,如果致癌因子是感染性病原體,則已有疫苗能用於預防癌症。此外,藉由生物技術的不斷精進,一些新型傳遞工具,像是病毒載體、脂質奈米粒子等,再加上佐劑及mRNA抗原的開發,進一步讓疫苗應用於癌症治療(圖一)。
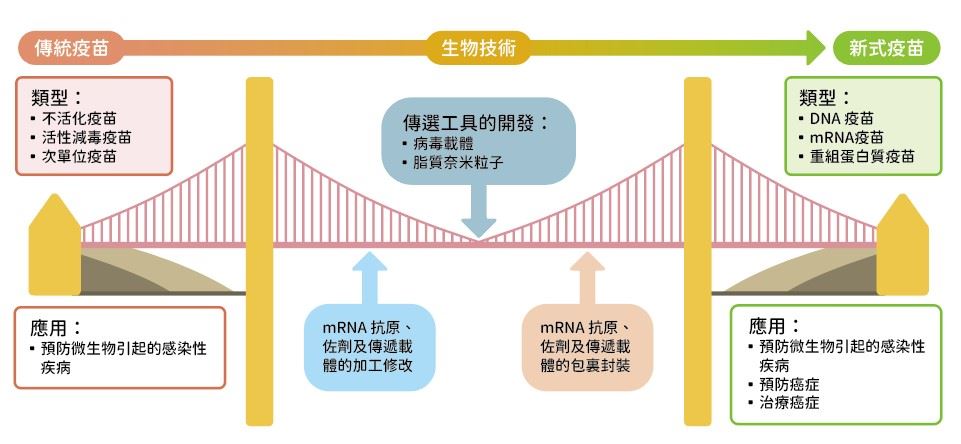
國一|生物技術的開發築起了一座由傳統疫苗通往新式疫苗的橋樑
預防子宮頸癌和肝癌的疫苗
用於預防癌症的疫苗,施打目的為降低人類產生腫瘤的風險。要研發此類疫苗,最重要的兩個課題是找出此類疫苗接種的適用範圍群體,並且選擇適當的抗原以建立對抗實體腫瘤後天免疫的記憶。在此前提下,腫瘤相關的抗原包括過度表現或突變的蛋白質和生長因子受體,並適合作為引發後天免疫反應的潛在標靶。現階段已有HPV疫苗和HBV疫苗受美國食品藥物管理局(Food andDrug Administration, FDA)核准,分別用於降低人類罹患子宮頸癌和肝癌的風險,在臨床試驗中,這類疫苗也被發現能顯著預防相關病毒感染及癌症發生的功效。以下我們將更詳細介紹HPV疫苗和HBV疫苗的成效。
Gardasil®(4vHPV)是一種非感染性重組四價疫苗,由四種HPV類型(6、11、16和18)主要核殼蛋白的高度純化的類病毒粒子(virus like particle, VLP)製備而成。Gardasil®是FDA於2006年批准用於9∼26歲女性的第一種四價HPV疫苗,用於預防子宮頸癌、尖銳濕疣、外陰和陰道癌前病變。Gardasil-9®(9vHPV) 則是FDA於2014年核准,用於13∼26歲女性和13∼21歲男性的第二代九價HPV疫苗,可額外預防另外五種高危險HPV類型(31、33、45、52和58)的感染。該疫苗可分別提供約90%的女性子宮頸癌、80∼95%的男性及女性其他HPV相關肛門生殖器發生癌症的保護力。然而,由於HPV類型在不同地區的盛行率和分布有所差異,因此涵蓋的類型也受到限制,HPV疫苗在不同地區的保護率不同。
去(2023)年,美國研究人員研究四價HPV(qHPV)疫苗,可以針對HPV感染和相關疾病提供持久的保護。他們在長期追蹤(long-term follow up)的臨床試驗中,發現疫苗在青少年、男性和女性中表現出持久的有效性、免疫原性(immunogenicity)和安全性,沒有出現任何突破性感染。研究結果顯示qHPV疫苗無需加強接種即可提供超過十年的有效性和安全性,結論是HPV疫苗可以顯著預防個體受到HPV感染,並能有效避免接種前的感染發生症狀。
在2022年,香港研究人員透過評估1988年香港全民HBV疫苗接種計畫執行前後出生的年輕人,探討接種HBV疫苗對慢性B型肝炎感染盛行率,以及肝癌、肝臟事件發生率的影響。在這項回顧性觀察隊列研究(retrospective observational cohort study)中,將1988∼2002年疫苗接種期間出生的5萬3960名受試者列為已接種疫苗,與1970∼1987年期間出生的31萬8290名未接種的受試者做比較。他們發現慢性HBV感染率從1970年出生的受試者的14.3%,下降到1988年出生的受試者的6.7%。此外,比較接種疫苗和未接種疫苗的受試者,分別有44人(0.1%)和75人(0.1%)接種疫苗受試者,以及1305人(0.4%)和1806人(0.6%)未接種疫苗受試者出現了肝癌和肝臟相關疾病。研究結果顯示,接種HBV疫苗的受試者肝癌發生率顯著低於未接種疫苗的受試者。這項研究顯示,普遍接種HBV疫苗會降低慢性B型肝炎感染的盛行率,並降低肝癌和肝臟相關疾病的發生率。
疫苗用於治療癌症
癌症疫苗的觀念源自癌症免疫療法。免疫治療可分為被動型和主動型,前者是提供來自體外的抗體或過繼型T細胞(adoptive T cell)以破壞腫瘤細胞;後者是使用疫苗刺激或恢復自身免疫反應,進而殺死腫瘤細胞。因此相較於前述的預防性疫苗,治療性疫苗在目標抗原和疫苗平臺上都發生了顯著的變化。
目前FDA已批准三種治療性癌症疫苗,包含TICE®(膀胱內注射卡介苗)用於治療膀胱癌(1998年)、Provenge®(sipuleucel-T)用於治療前列腺癌(2010年)、Imlygic™(T-VEC)用於治療轉移性黑色素瘤(2015年)。先前的臨床試驗顯示,治療性疫苗通常表現出很好的耐受性,可作為標靶腫瘤的新抗原(neoantigen),並有誘導抗原級聯反應(antigen cascade)的能力。
現階段相關領域正在進行的研究重點則包括:
1. 探索標靶作用到腫瘤細胞的新抗原。
2. 將疫苗與奈米粒子或佐劑相結合。
3. 將疫苗與標準療法或其他免疫療法結合的合併療法,但仍須評估這些方法用以提高疫苗的功效。
接下來將舉例介紹幾個最近的治療性疫苗發展。今(2024)年,義大利、英國、比利時、瑞士及西班牙等多國研究團隊人員使用個人化疫苗NOUS-PEV與單株抗體pembrolizumab,聯合治療從未接受過任何治療的轉移性黑色素瘤患者,進行Ib期臨床試驗。NOUS-PEV由非人猿腺病毒載體(great ape adenovirus 20, GAd20)誘發產生,能表現60種新抗原。研究人員評估所有治療方案,檢測到新抗原產生後天免疫反應,包括對抗多種新抗原的輔助型T細胞(T helper cell, Th)和細胞毒殺型T細胞(cytotoxic T cell)。研究結果顯示,NOUS-PEV可以擴大腫瘤反應性T細胞的範圍,從而產生多樣性、強大和持久的抗腫瘤免疫反應。由此成果來看,研究人員認為有機會提供標靶對準多種癌症抗原的個人化疫苗,藉此誘發對抗腫瘤異質性的多種T細胞反應,在未來成為更有效的治療手法。
來自中國北京醫藥科學院的研究人員也在今年開發了一種由脂質奈米粒子配製而成的HPV治療性mRNA疫苗(mRNA-based HPV therapeutic vaccine-2, mHTV-02)。在動物實驗中,此疫苗標靶設定為小鼠體內HPV16和HPV-18的E6/E7致癌基因,結果發現mHTV-02顯著引發抗原特異性細胞免疫和有效的記憶T細胞免疫。此外,也產生顯著的細胞毒殺型T細胞浸潤和細胞毒性,使表現HPV E6/E7的TC-1腫瘤生長受到抑制,並提高了罹患腫瘤小鼠的存活率。與靜脈注射疫苗相比,肌肉或腫瘤內注射mHTV-02更能夠減少腫瘤大小或延長小鼠存活率,展現更好的治療效果。此研究結果顯示,透過特定給藥途徑的mHTV-02,有可能成為治療與HPV16或HPV18感染相關的惡性腫瘤的候選治療性mRNA疫苗。
去年,韓國國立首爾大學的研究人員探討將HBV衍生的Poly6佐劑與B型肝炎病毒表面抗原(Hepatitis B surface antigen, HBsAg)結合,作為疫苗治療肝癌;並在動物實驗中,研究C57BL/6小鼠或第一型干擾素受體α鏈被踢除(knockout)的HBV基因轉殖小鼠對抗HBV感染的可行性,他們發現以Poly6刺激樹突狀細胞生長,使用於植入腫瘤的小鼠展現了強大的抗癌能力。研究結果顯示,Poly6在C57BL/6小鼠中以第一型干擾素依賴性模式,增加樹突狀細胞成熟和遷移。而且如果將Poly6添加到明礬中與HBsAg結合,將增強HBsAg特異性細胞控制的免疫力,這表示Poly6有作為治療性HBsAg疫苗佐劑的潛力。此外,Poly6結合HBsAg疫苗接種在HBV基因轉殖小鼠中,透過第一型干擾素依賴性活化樹突狀細胞來引發對HBV具有專一性的體液性和細胞性免疫反應,顯示出對抗HBV感染的有效作用。Poly6還會誘導HBV特異性記憶T細胞,可顯著抑制病毒感染,並將HBV抗原降低至較低的濃度,可見它具有作為肝癌治療性疫苗佐劑的潛力。
癌症疫苗的前景和挑戰
治療性癌症疫苗用於誘導免疫系統專門對抗現存的癌細胞。由於癌細胞在個體中存在差異,所以患者通常需要個人化治療或精準治療(precision medicine),必須評估患者的適應性、對治療的反應和經濟能力。此外,這些疫苗的技術發展應特別關注特定抗原的選擇和傳遞、人類疫苗接種後反應的監測,以及新方法的改進。新抗原為辨識癌細胞提供了方向,但需利用新的生物技術和生物資訊學工具來探索新抗原的組成及結構。此外,誘導腫瘤特異性T細胞進行免疫治療,並延長患者的生存期也很重要。治療性癌症疫苗已被證明可以增加T細胞的數量及功能,但在現階段仍然很難引發顯著有效的T細胞數量及功能增加,以達到治療的最低限度。
目前用於癌症治療的mRNA疫苗研究進展迅速,部分臨床試驗的結果顯示此類疫苗有機會對抗多種實體腫瘤。mRNA抗原、佐劑和遞送載體是mRNA癌症疫苗的三個主要組成部分,但它們在體內通常不穩定且難以開發。若能適當改造這些成分,將有機會增強mRNA癌症疫苗治療的效果,例如透過適當修飾mRNA的結構,提高穩定性和先天免疫原性、使用適當的遞送載體提高體內遞送效率。進一步策略包括調節免疫抑制腫瘤環境、調整給藥途徑、開發標靶目標細胞或組織的遞送載體及應用聯合治療等。疾病相關抗原的鑑定,以及誘導這些標靶的免疫反應可以加速疫苗的開發。為了提高治療潛力,下一個重要步驟是改進這些疫苗,包括安全性、有效性和長期效果,並在臨床試驗中進行評估。如果能夠解決和克服mRNA癌症疫苗臨床應用的挑戰,mRNA疫苗預計將可以在不久的將來應用於人類癌症治療。
疫苗的臨床應用已從預防感染性疾病延伸至非感染性疾病,從只能預防疾病擴展到治療疾病,特別是癌症的治療,更是目前疫苗研發的嶄新重點方向。更重要的是,治療性癌症疫苗的快速發展提供了癌症治療一種具有潛力的新方法,或許可在未來提供癌症患者替代性的治療選擇。
延伸閱讀
1. Shi, L. et al. (2007). GARDASIL®: prophylactic human papillomavirus vaccine development–from bench top to bed‐side. Clinical Pharmacology & Therapeutics, 81(2), 259-264.
2. DeMaria, P. J., & Bilusic, M. (2019). Cancer vaccines. Hematology/ Oncology Clinics, 33(2), 199-214.
3. Poria, R. et al. (2023). Vaccine development: Current trends and technologies. Life Sciences, 122331.