- 科技報導
- 焦點話題
文章專區
2024-12-16小小線蟲再立大功 miRNA的發現與應用
516 期
Author 作者
羅時成/長庚大學生醫系客座教授,研究領域為分子病毒學、細胞學與發育生物學
今(2024)年的諾貝爾生理與醫學獎第三度頒發給研究線蟲的科學家,本次獲獎的得主分別為安布羅斯(Victor Ambros)和魯夫昆(Gary Ruvkun),以表彰他們發現線蟲時序調控基因「微型RNA」(microRNA, miRNA)。miRNA是一種非編碼基因,可用來做轉錄後的基因調控,且普遍存在於各類動植物中,並在分子生物學基因調控中建立了新典範。
分子生物學的誕生
1953年,華生(James Watson)和克里克(Franics Crick)解開DNA的雙股螺旋結構,從此揭開了分子生物學的序幕。他們發現DNA做為生物遺傳物質,可以透過解開雙股、各自作為模板合成互補股,並複製產生兩個完全相同的DNA,科學史家認為他們的發現是生命科學的第一次革命。而在1958年,克里克更進一步提出分子生物學的中心法則(central dogma),說明遺傳訊息會由DNA轉錄(transcription)成RNA,再由RNA轉譯(translation)成蛋白質,最後由蛋白質執行生命現象。之後的十年,許多分子生物學的奧祕陸陸續續被揭開,包括DNA聚合酶(DNA Polymerase)的發現及證實利用DNA聚合酶可以在試管內進行DNA複製,也證實細胞內mRNA的存在及mRNA每三個核苷酸會形成一個密碼子(codon),對應至一個胺基酸進行轉譯,並了解64個密碼子中的唯一的起始碼(AUG)對應到甲硫胺酸(methionine),而三個終止碼(UAG、UGG、UGA)則不對應到任何胺基酸而會使轉譯中止,發現這些重大事件的分子生物學家皆先後得到了諾貝爾獎。
1963年6月,證實mRNA存在於細胞內的布瑞納(Sydney Brenner)向他任職的卡文迪西實驗室(Cavendish Laboratory ) 所長皮魯茲(Max Perutz,1962年諾貝爾化學獎得主)寫了一封信,信中提到:「親愛的馬克斯,⋯在過去十年內,幾乎所有『古典』分子生物學的問題不是已被解開,就是在未來十年將被解開。我對分子生物學未來的研究,深感需要延續生物學不同領域來發展,比如重要的發育生物學和神經系統。因此我們要利用多細胞生物來作研究,牠需具有生活週期短的特性,像微生物一樣,容易養、體積小,可作大量的操作。牠應該只有很少的細胞數,可供深入細胞譜系的追踪,以及生物形態產生的研究,而且牠要有足夠量方便遺傳學的分析。」
模式動物-線蟲
於是自由生活在土壤且不具感染性的秀麗隱桿線蟲(Caenorhabditis elegans,簡稱線蟲),就被布瑞納挑選為模式生物。因為線蟲在實驗室中的飼養相當容易,只要餵食牠們大腸桿菌(Escherichia coli)、培養在25℃的溫度下即可。線蟲自體受精的卵會經過L1、L2、L3、L4等四個幼蟲期,幼蟲成為有生殖能力的成蟲只需三天半,且線蟲從受精卵到成蟲的狀態皆透明可見,便於利用顯微鏡進行細胞分裂和細胞譜系的觀察與追蹤。此外,成蟲身長約一毫米(mm),體細胞只有1000個左右,符合布瑞納理想中小型、簡單多細胞動物的條件。線蟲成體可分為雌雄同體和雄體,兩者都具有五對體染色體(染色體I∼V號),但前者有兩個性染色體(XX),後者僅具有一個性染色體(XO)。雄蟲在自然界較少,出現機率約為0.1%。一般雌雄同體的線蟲可經由同體受精繁殖後代,而在L4幼蟲末期,精原細胞經減數分裂會產生約300個單套染色體的精子。這些不具鞭毛、行阿米巴運動的精子,會先儲存在儲精囊內,成體時線蟲精原細胞的基因序列出現改變、開始產生卵子,卵子便會再和儲精囊內的精子結合形成受精卵。因此,一隻雌雄同體的線蟲一生約可產生200∼300隻子代。在理想狀態下,線蟲成蟲一星期內就可產下近一萬隻後代,且每隻後代具有相同基因,有如無性生殖的生物體,使牠們的基因可維持在純品系,提供簡單方便的遺傳分析。
因此,布瑞納試著以化學誘變劑「甲磺酸乙酯」(ethyl methanesulfonate, EMS)處理線蟲,通常經過EMS處理過的線蟲第一子代(F1)表現型不會有明顯變化,但是F1自體繁衍產生來的第二子代(F2),就有可能出現數量約為整體子代1/4的突變株。將這些F2出現的突變株單獨取出來培養,得到的第三子代(F3)如果全是突變株,就可以獲得純品系的突變株。這些突變株可以再進一步培養以擴增數量,並以冷凍保存,就能夠隨時解凍培養實驗用線蟲。布瑞納花了近十年,獲得300餘株與行為運動有關的線蟲突變株,他還透過雜交將每株的突變點定位於體染色體I∼V號及性染色體X上,建立了線蟲遺傳學的基石。
布瑞納的學生在之後的研究中陸續利用他建立的方法和基礎,開展發育和神經領域的研究,終於在本世紀初開花結果。2002年,布瑞納、霍維茲(Robert Horvitz)、薩爾斯頓(John Sulston)師徒三人共同獲得諾貝爾生理學與醫學獎,以表彰他們在器官發育與細胞凋亡(apoptosis)研究的貢獻。2006年,諾貝爾生理學與醫學獎再度頒給線蟲科學家——法厄(Andrew Fire)和梅洛(Craig Mello),獲獎原因是他們發現雙股RNA(double-straand RNA)會造成基因靜默(gene silencing)的現象。2008年獲得諾貝爾獎化學獎的查爾菲(Martin Chalfie)則是布瑞納的博士後研究員,他對於綠色螢光蛋白(green fluorescent protein, GFP)的應用具有重大貢獻。今年的諾貝爾獎再度頒給線蟲科學家,以表彰他們發現時序調控基因lin-4和let-7的產物是長度只有22個核苷酸的miRNA,且這種非編碼基因可用於轉錄後的基因調控。
線蟲時序基因的發現
時序基因(heterochronic gene)對於動植物的發育非常重要,如果此基因調控失常,將造成動植物發育的遲緩(retardation)或早熟(precocious)等狀況。由於線蟲的生活週期只有三天半,是一種用於研究時序基因調控的理想模式,再加上線蟲的四個幼蟲期(L1∼L4)皆很好辨識,如果基因發生突變可能會造成牠的發育停滯在L1時期,稱作滯留型突變;若是線蟲從L3階段直接跳到成蟲,則稱做早熟型突變。
安布羅斯和魯夫昆實驗室在研究線蟲發育的時序調控時,獲得一株滯留型的突變株(lin-4)。他們此時已經知道lin-4可以負調控它下游的基因lin-14,使LIN-14蛋白無法被製造。安布羅斯實驗室想了解lin-4基因到底含有多少核苷酸,於是使用微注射的方式將含有lin-4的DNA片段打入突變株的卵細胞內,發現此線蟲產生的後代(F1)恢復為野生型。然而,這個能夠拯救滯留型線蟲的DNA片段只有693個鹼基對(base pairs),且不具有可以產生蛋白質的序列。為了慎重起見,他們另外又利用親緣關係相近的雙桅隱杆線蟲(Caenorhabditis briggsae)中,同源對應、具有693個鹼基對的DNA片段(同樣不含可產生蛋白質的序列)進行拯救lin-4突變株的實驗,最終獲得相同結果。他們也比較同一段基因序列在其他四種隱杆線蟲屬(Caenorhabditis)線蟲身上的情形。實驗結果顯示,lin-4基因在種間屬於保守序列(conserved sequence);接著他們也證明lin-4基因可以產生兩種長短不一的RNA——lin-4S、lin-4L,分別含有22個核苷酸(22-nt)和61個核苷酸(61-nt)。22-ntRNA(即為miRNA)是由61-nt(即為pre-miRNA)剪切後形成,可以和另一個時序基因lin-14產生的mRNA3'非轉譯區(3'untranslated region, 3'-UTR)互補,抑制蛋白質的產生。
1993年,兩間實驗室分別將這項成果發表在《細胞》(Cell)期刊。但這項突破性的發現,當初並未受到生物學家的重視,他們認為僅有線蟲使用這種miRNA做轉錄後(post-transcription)調控,而其他生物身上並不會出現此現象。直到2000年,魯夫昆實驗室又發現了第二個時序調控基因「let-7」,他們以電腦比對各種生物的基因庫序列,發現let-7的核苷酸的序列也出現在其他生物體中,因此打開了這扇大門——miRNA的調控其實是一種普遍出現在生物界的現象。
miRNA的產生和作用
當發現miRNA對蛋白質的調控不僅只出現在線蟲身上,而是一種普遍的生物現象後,激發許多科學家開始朝向這個領域進行研究,像是探討miRNA如何產生、每種生物到底有多少種miRNA、哪些mRNA會受到miRNA調控?
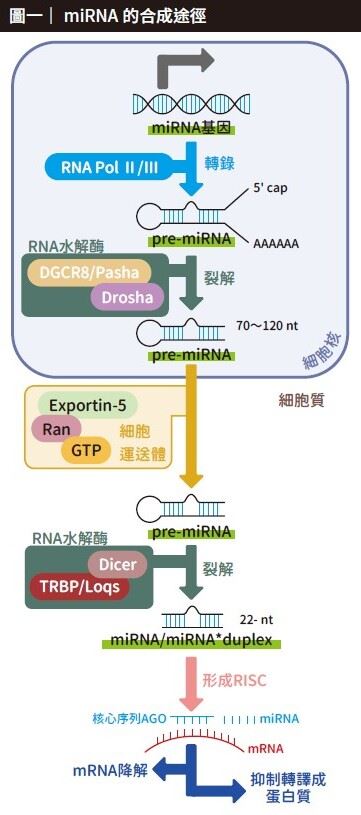
經過20多年的研究,目前科學家在271個物種中找到3萬8589種miRNA,而人類則具有超過2000種miRNA。此外,科學家也逐漸了解miRNA的合成途徑,大多都是經過自身DNA序列中的啟動子(promoter),由RNA聚合酶(RNA polymerase II或III)轉錄出pri-miRNA,然後在細胞核內經RNA水解酶(內含Drosha/DGCR8)組成的複合體(microprosessor),將pri-miRNA剪裁變成為約70∼120 nt的pre-miRNA,再透過蛋白質XPO5(Exportin-5)將pre-miRNA輸送到細胞質,經過三種不同的RNA水解酶(Dicer/TRBP/Ago2)處理產生成熟的miRNA。最後,miRNA結合RNA誘導沉默複合物(RNA-induced silencing complex, RISC) 後再和標靶mRNA結合,造成該mRNA無法生成蛋白質或降解(圖一)。由於miRNA和mRNA序列並不需要完全互補,只要有幾個核心核苷酸能夠對上即可,因此一個miRNA便可以對應到一個以上的不同mRNA,而一個mRNA也可以受數種不同的miRNA調控。
接下來,科學家開始陸續找尋不同物種的miRNA對生物體的影響。除了對發育器官造成影響外,它也會影響到癌症。由於癌症的產生機制之一包含抑癌基因的失能,像是人類的抑癌基因P53受到miR-34調控;其他的抑癌基因則分別被miR-7、 miR-124 、miR-137、miR-146b等不同miRNA調控。研究發現miRNA可以經由外泌體(exosome)分泌到細胞外,甚至進入血液中,因此有些癌細胞就可以分泌miRNA到它們想要轉移的組織、建立新的微環境,進而達成轉移的目的。除了癌症外還一些傳染性疾病,例如第四型人類皰疹病毒(Epstein-Barr virus, EBV)會感染B淋巴球,它便會利用自己的miRNA(即v-miRNA)長期住在B淋巴球內形成慢性感染。此外,它甚至還能竊取B淋巴球miR-21、miR-23a、miR-24、miR-27等的功能,讓淋巴球成為淋巴癌細胞,因此臨床上可以研發抑制miRNA功能的藥物來對抗癌症。
修正中心法則的miRNA
一般來說,諾貝爾獎不會重複給予類似的研究的題目,所以有些研究者覺得這次的獲獎和2006年小分子干擾RNA(small interfering RNA, siRNA)的發現有重疊,因為兩者都會藉由Dicer複合蛋白抑制mRNA的功能。但筆者認為兩者有顯著的不同,siRNA的發現屬於應用,而miRNA的發現則屬於基礎學理,修訂了中心法則中認為RNA都是用來轉譯蛋白的概念。miRNA可以作為蛋白質產生的調控者,除了有些miRNA擁有自己的啟動子外,有些miRNA位於其他有蛋白質編碼基因的內含子(intron)內,更加解釋了傳統上被認為「無用」的非編碼DNA實際上具有重要的生物功能。最後,如果要預測未來還有可能獲得諾貝爾獎的線蟲研究,筆者認為發現有關調控生物壽命長短的基因(daf-2/daf-16)最有機會。
筆者誠摯感謝王文竹老師和邱韻如老師對本文的斧正和建議。