- 科技報導
- 焦點話題
文章專區
2024-09-23從藥物開發到疾病研究 仿生肺器官晶片的進程與展望
513 期
Author 作者
陳冠宇/國立陽明交通大學電機學院生醫工程研究所教授。莊紫妤/國立陽明交通大學電機學院生醫工程研究所碩士班研究生。賴懿庭/國立陽明交通大學電機學院生醫工程研究所碩士班研究生。
器官晶片(organ-on-a-chip)是一種創新的生物技術平臺,目的在於替代傳統動物實驗、模擬人體器官的微環境,並以微流體系統培養細胞及重現人體內的組織結構。器官晶片可提供更準確且可靠的實驗結果,有助於研究人體疾病的生理機制和評估藥物療效與毒性,並加速新藥開發的流程,為生命科學和醫學研究帶來新的前景。
器官晶片對藥物開發的重要性
2022年12月,美國食品藥物管理局(Food and Drug Administration, FDA)推出了「FDA現代法案2.0」(FDA Modernization Act 2.0),批准新藥動物試驗的替代方案,其中就包括了近年來備受關注的器官晶片技術。現今的新藥開發時程平均需要10∼15年,耗費成本通常在10∼20億美元之間,目前藥物在臨床前驗證的標準仍使用動物模型,可提供藥物在生物體內的代謝及分布狀況等重要資訊。然而研究顯示,動物與人類的基因組和生理結構存在差異,因此動物實驗結果無法完全體現人體的疾病特徵,難以精準模擬人類在疾病發生時的生理反應變化。若因錯誤的實驗結果導致對人體有害的藥物進入市場,將引發嚴重的健康風險,甚至可能導致患者死亡。因此適當的動物替代技術,是近年來備受矚目的焦點之一。器官晶片結合了組織工程與生物晶片技術,成為一項極具潛力、未來發展也備受關注的動物替代技術。由於器官晶片可以模擬人體器官環境和器官的功能,因此能提供科學家更準確的藥物測試平臺,並用於研究人類病理生理學和評估藥物的安全性和有效性。
器官晶片不僅能重現更具仿生性的立體組織結構,同時還能以動態的輸送方式模擬血液循環。相較於傳統的二維細胞培養或動物實驗,器官晶片可以更快速且準確的預測藥物在人體的療效或毒性,降低實驗成本並加速新藥的研發過程。另外,此項技術在精準醫療與個人化醫療也有很大的應用潛能,可以將患者的特異性參數建立於晶片中,幫助臨床上識別早期生物標誌物並監測疾病進展,針對患者的病情提供最佳治療方案,近年來已有許多研究運用這項技術,建立個人化的體外疾病模型。
目前常見的器官晶片結構,會根據特定器官的結構去設計尺寸、形狀和流道。其中,單流道晶片為最簡易的結構,可以模擬藥物初期的毒性測試或是藥物篩檢,但無法重現體內複雜組織的微環境。雙層流道則利用多孔薄膜分隔平行與垂直流道,設計出可獨立控制的流體,不僅具有高度滲透性,還可有效提供營養物給細胞和培養基進行物質的交換,在晶片內重現複雜的生理機制與結構。對於人體肺部、腎臟、大腦等結構與組成較為複雜的器官,雙層流道晶片模型能夠更真實的模擬它們的功能和反應。
陽明交大仿生肺晶片技術
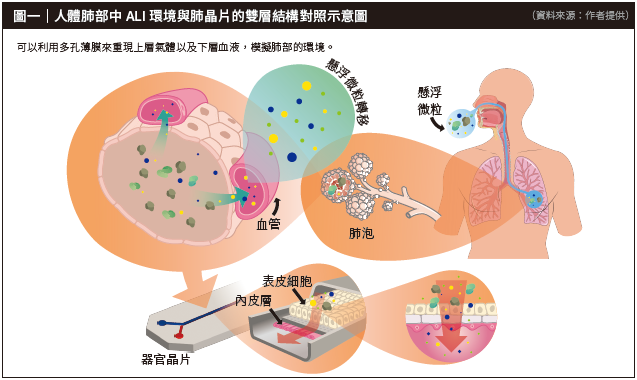
筆者研究團隊開發的「人體仿生肺晶片吸入試驗替代系統」,就是以雙層流道晶片模型模擬肺部功能。在呼吸系統中,由肺泡上皮細胞間的緊密連接(tight junction)和肺泡中的血液-氣體屏障(blood-air barrier)構成對抗外部病原體侵入的第一道防線,不僅有效防止分子與離子從血液滲透到肺泡空腔中,還能維持氧氣與二氧化碳的擴散作用,形成穩定的氣液介面(air-liquid interface, ALI)。重現前述的ALI環境,對於發展肺部體外模型來說至關重要,如果能成功模擬ALI環境,不僅能夠誘導所培養的特定細胞分化出纖毛(cilia)與分泌黏液(mucus)等重要的生理功能,同時也能重現呼吸道輸送現象,幫助藥物以吸入性方式作用於細胞,並精密地控制藥物劑量和試驗條件。
現階段團隊已開發出在晶片上建構肺組織的仿生技術,在體外成功模擬肺部氣液介面與氣道上皮屏障的功能,更能於該系統觀察到黏液與纖毛所產生的協同作用──黏液纖毛清除行為(mucociliary clearance, MCC)。肺部藉由此作用捕捉並移除吸入的微生物、灰塵和其他異物,因此這款晶片高度還原了肺部的細胞結構、組織介面、物理化學微環境等真實情況。除此之外,應用微流體裝置的肺部晶片具有動態灌注、模擬血液循環的特色,更跳脫傳統細胞靜態培養的侷限,能進一步模擬體內氣體與血液流動的生理狀況,有助於探討細胞在不同力學環境下的行為與功能。器官晶片的特徵模擬相當精確,目前已驗證與人體相關組織結構的一致性和可重複性高達95%,不僅可以準確地反映患者肺部的生理病理狀況,還能在未來用以有效地評估藥物吸收、毒性,以及藥物在呼吸系統中的功效,並深入研究各類肺部疾病的病理機制和治療方法。
仿生肺器官晶片應用實例
目前已有大量研究指出,懸浮微粒(particulate matter, PM)是直接導致肺部健康問題的主要原因,它的組成成分複雜且會經由多種途徑進入人體內。為了釐清空氣汙染物及細懸浮微粒〔註〕所帶來的健康影響與損傷機制,筆者研究團隊已完成空汙健康平臺的建立與開發,將空汙粒子中常見的兩種成分——二氧化矽奈米粒子(SiO2)及柴油引擎廢氣微粒(diesel exhaust particles, DEP)動態暴露至仿生肺晶片當中,模擬人體吸入PM的損傷過程(圖一)。藉由測定組織的屏障功能與量測PM的滲透率進行分析,實驗與臨床結果皆說明二氧化矽和DEP會顯著造成組織損傷與屏障功能下降,證實仿生肺晶片在進行懸浮微粒評估的可靠性與潛力。未來更可以進一步利用該晶片系統探討懸浮微粒對人體呼吸系統導致的健康問題,為空氣汙染防制發展帶來另一個方向的解讀與方針。
〔註〕粒徑≤2.5 微米(μm)的懸浮微粒。
(資料來源:作者提供)
當長期暴露於有毒顆粒或氣體的環境中,經常會引起肺部不正常發炎反應及黏液過度分泌與氣流堵塞的情況,不僅限制了氣流進出肺部,更可能導致肺組織出現不可逆的損傷,最常見的疾病之一即為慢性阻塞型肺病(chronic obstructive pulmonary disease, COPD)。臨床上,目前仍無法通過藥物扭轉COPD的病理變化,主要原因是科學家對此疾病複雜的作用機制了解相當有限。為了探索疾病進程涉及到的分子與生化機制,利用肺晶片技術創建疾病模型即為關鍵解方。在技術面上,如何呈現黏液纖毛的分化異常及細胞屏障的損害,是現今面臨的主要挑戰。值得一提的是,目前筆者團隊已經可以在晶片中創建健康與疾病患者的生理環境,建立不同黏液特徵的肺晶片,並透過晶片上的病變特徵進行藥物開發的評估。
在體外重現器官組織的生理結構及動態微環境,除了有助於了解疾病進展,更能進一步提升新藥開發的準確性。仿生肺晶片系統現階段已突破過往體外實驗的限制,可以還原細胞受到氣流及液體流動所造成的剪切應力影響,更能深入探討吸入性藥物進入氣道後與氣道上皮組織之間的交互作用和沉積行為。筆者團隊過往的研究發現,原先用來治療瘧疾的氯喹(chloroquine, CQ)與對抗寄生蟲的伊維菌素(ivermectin, IVM),在COPD中可以分別調節纖毛和黏液的分化,並顯著改善肺部組織所受的影響。與傳統體外模型的研究結果相比,使用仿生肺晶片系統可以產生與臨床環境相當的生理和發炎反應,並加速特定生物標記的識別以供進一步分析,藉此觀察藥物在肺部的傳遞效果、吸收速度、生物活性,確保藥物能夠有效地到達目標部位,提供最佳的治療效果,省下高額的藥物開發成本並提高藥物研發的生產力。
器官晶片的前景與挑戰
雖然目前器官晶片技術已被廣泛發展,但若需要進行複雜流道和流體的控制或是即時進行檢測,將會面臨實驗過程費時的問題,導致細胞在經過多個時間點的分析後失去活性。因此,如何有效提升實驗吞吐量以快速完成實驗,縮短研發週期、降低成本,將會是器官晶片技術需要突破的挑戰。筆者團隊開發的體外仿生晶片系統,以動物替代為核心,提供更準確且有效的藥物標準化篩選平臺,降低成本並大幅縮短藥物開發進程。
近期所成立的衍生新創公司「久浪智醫」,聚焦在Bio-AI晶片技術的應用,並結合國內原有的半導體技術,實現智慧醫療與資通電的技術整合,從而擴展至疾病預防、個人化模型建立、美妝保養等領域。未來也預計與國內臨床、產業及國際頂尖單位合作,整合眾多上下游相關產業鏈,讓世界看到臺灣在仿生晶片上的研發成果跟能量,共同以前瞻和創新技術解決當前世界上重要的健康問題。
延伸閱讀
1. Huh, D. et al. (2010). Reconstituting organ-level lung functions on a chip. Science, 328(5986), 1662-1668.
2. Lin, K. C. et al. (2022). Development of an alveolar chip model to mimic respiratory conditions due to fine particulate matter exposure. Applied Materials Today, 26, 101281.
3. Chen, S. L. et al. (2022). Investigation of the role of the autophagic protein LC3B in the regulation of human airway epithelium cell differentiation in COPD using a biomimetic model. Materials Today Bio, 13, 100182.