- 專欄
文章專區
2024-08-01讓二氧化碳變身燃料、化工原料! 電催化二氧化碳還原機制
656 期
Author 作者
林汶諭/成功大學化學系;鄭沐政/成功大學化學系教授。
Take Home Message
•電催化二氧化碳還原反應透過調控電位、催化劑或電解液,將二氧化碳還原為一氧化碳、甲烷、乙烯等可用於燃料、化工原料或日常用品的產物。
•使用金屬或氧化物電極的二氧化碳非勻相催化是目前研究的焦點,此方法可以解決產物與催化劑的分離問題,而金屬銅催化劑又特別受到關注。
•筆者團隊發現,碳中間體可以直接與二氧化碳結合,且此機制的反應活性更高,能提高二氧化碳轉化成高價值化學品的效率。
現代科技發展迅速,全球的能源需求也急遽增加。臺灣目前的電力主要來自於火力發電,但是這類方式會排放大量二氧化碳。除此之外,工業活動和交通運輸也會產生不少二氧化碳。種種原因使得大氣中的二氧化碳濃度上升,進一步引發全球暖化、氣候變遷等危機。為了解決此問題,許多科學家提出利用「電化學催化技術」,將工廠排放的廢棄二氧化碳轉化成有價值的燃料或化學品,從而實現負碳排放,減緩環境的壓力。

(Adobe Stock)
電催化二氧化碳還原反應
化學反應是指物質發生變化的過程,包括生成新的化學鍵或是化學鍵的斷裂等。其中,有些化學反應會自然發生,無需外加能量;但也有一些反應需要藉由電能、光能、熱能等外部能量,才能使原本在常態下無法進行的反應發生。而電化學反應就是利用電能促使反應的進行,例如電鍍、電解水反應。
常見的電化學反應系統包括電解質與電極,電解質用於導電與維持系統的電中性,而電極則是反應發生的地方。電化學反應的過程伴隨著電子轉移,藉由調整電位的大小就可以改變電極上電子的能量,使電子轉移發生。就如同水往低處流的道理,電子也會從能量高點流向能量低點。舉例來說,當電極上的電子能量高於反應物中能量最低且未被電子占據的分子軌域(lowest unoccupied molecular orbital, LUMO),電極上的電子就會轉移到反應物上,使得反應物因接受電子而發生還原反應。相反的,如果電極內的電子能量低於反應物中能量最高且被電子占據的分子軌域(highest occupied molecular orbital, HOMO),反應物上的電子就會轉移到電極上,反應物便會因失去電子而發生氧化反應。
所謂的電化學還原反應,就是利用電能促使還原反應發生(圖一)。然而,要用這種反應還原二氧化碳並不是一件簡單的事情,原因在於二氧化碳是一種非常穩定的物質,必須消耗大量能量才能破壞二氧化碳的化學鍵――這樣的能量使用不僅不切實際,還會大幅增加所需的電能,進一步加劇溫室效應。因此,若想讓反應發生就需要催化劑的幫助,催化劑可以改變反應途徑進而降低反應所需的活化能;同時,催化劑的質量與組成在反應前後皆保持不變,在反應中能夠不斷地循環、重複被利用。這樣一來,原本需要高能量才能發生的電催化二氧化碳還原反應,現在只需要較少的能量就能夠進行。……【更多內容請閱讀科學月刊第656期】
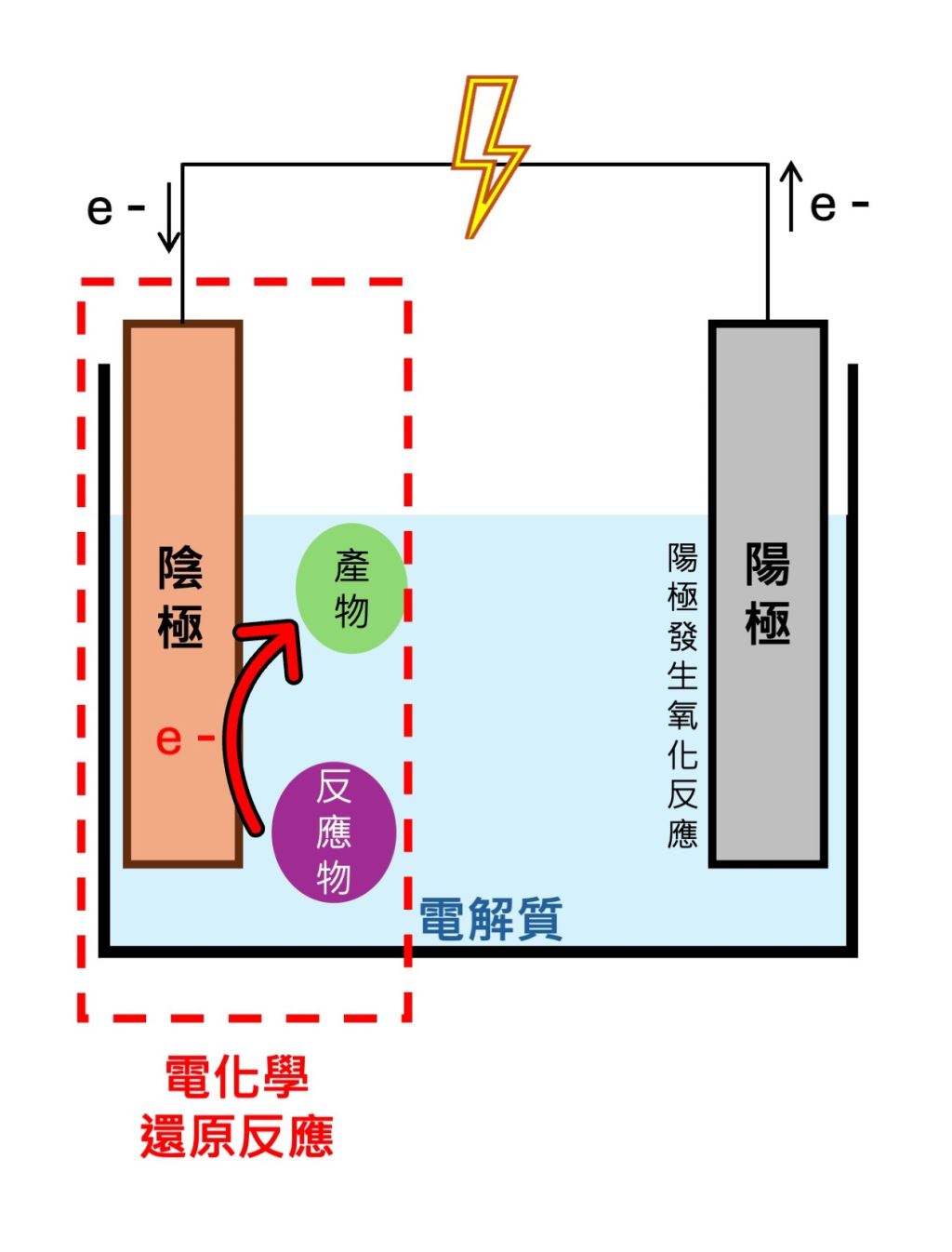
圖一|電化學還原反應(林汶諭繪製)
當電極上的電子能量高於反應物中能量最低且未被電子占據的分子軌域,電極上的電子就會轉移到反應物上,使得反應物因接受電子而發生還原反應。